Если посмотреть слово «миф» в словаре, мы обнаружим несколько значений. Одно из них: выдумка или полуправда, нередко являющаяся частью идеологии. Такое определение предполагает, что мифы легко узнать, так как они не подтверждаются фактами. Проблема в том, что мифы часто подаются как факты. Например в одной работе (Jury (2006)) уже были развенчаны некоторые мифы и факты, описанные ниже, некоторые из них очень живучи. Это и натолкнуло нас на мысль написать данную статью, в которой мы рассматриваем мифы с научной точки зрения.Мифы — часть жизни, они проявляются во всём. В том числе и в аквариумном хобби, где анекдотические наблюдения и теории иногда превращаются в факты, несмотря на отсутствие доказательств. Часто наш выбор базируется на слухах и «фактах», распространяемых аквариумистами с самыми лучшими намерениями. В некоторых случаях мы, к сожалению, вводим в заблуждение сами себя. В данной статье мы рассмотрим некоторые из мифов, которые до сих пор присутствуют в морской аквариумистике и рассмотрим их с научной точки зрения. Мы всегда должны держать разум открытым, но относиться критически к заявлениям, не имеющим фактических подтверждений.
«Чем больше света получают кораллы, тем лучше»
Это один из самых живучих на сегодняшний день мифов, и, если быть честным, частично он является правдой. Аквариумисты, считая, что чем больше света, тем лучше, оснащают аквариумы светильниками максимальной мощности, какую могут позволить. Происходит миф от утверждения, что растущие на мелководье кораллы хорошо освещаются солнцем. И действительно, кораллы растущие на литорали несколько раз в день оказываются на открытом воздухе во время отлива, испытывая на себе всю мощь солнечного излучения с интенсивностью 2000 µmol m-2 s-1 в диапазоне благоприятном для фотосинтеза (PAR, ~400-700 nm) (Huang et al. 1995; Demmig-Adams et al. 1996). Для сравнения, освещение в большинстве аквариумов находится на уровне 100-400 µmol m-2 s-1 (Kirda 2003). И хотя кораллы могут выдерживать высокий уровень освещения, не всегда он для них полезен. Фотосинтезирующие структуры симбиотических динофлагеллят, или зооксантелл, при сильном освещении прекращают работать и даже повреждаются (Osinga et al. 2011).
Чтобы справиться с сильным воздействием ультрафиолета (UV) и предотвратить повреждение тканей и кораллы, и зооксантеллы выработали всевозможные механизмы защиты. Один из механизмов, используемый кораллами — это выработка микоспориноподобных аминокислот (MAA’s) и флуоресцентных протеинов (Kinzie 1993; Dunlap and Shick 1998; Salih et al. 2000). MAA’s защищают кораллы и зооксантелл от вредного воздействия ультрафиолетового излучения на клеточные мембраны и ДНК. Флуоресцентные протеины, например зелёный Флуоресцентный протеин (GFP), который светится голубым светом, предположительно защищает кораллы от высокой концентрации свободных радикалов кислорода, образующихся в результате фотосинтеза (Salih et al. 2000; Bou-Abdallah et al. 2006). Голубой Флуоресцентный протеин может поглощать часть света в диапазоне, необходимом зооксантеллам для фотосинтеза (D’Angelo et al. 2008). Другая стратегия, используемая кораллами — втягивание полипов и затенение таким образом зооксантелл. При низком уровне освещения полипы кораллов всегда раскрываются максимально. В дополнение ко всему, скелеты кораллов способны превращать ультрафиолетовый свет в жёлтый, вероятно, уменьшая его опасность для тканей (Reef et al. 2009). В свою очередь, зооксантеллы рассеивают избыточную солнечную энергию в виде тепла в результате сложных процессов известных как нефотохимическое гашение и постоянно восстанавливают фотосинтезирующие органоиды, поддерживая их в рабочем состоянии (Warner et al. 1999; Jones et al. 2001; Hill et al. 2005).
Таким образом, кораллы не только не нуждаются в высокой интенсивности света, характерной для мелководий, но и пытаются с ней бороться и прекрасно себя чувствуют при слабом освещении. И действительно, фотосинтезирующие твёрдые кораллы найдены на глубине до 167 метров и вполне обычны на глубинах более 100 метров (Rooney et al. 2010; Bongaerts et al. 2011). Здесь они могут получить менее 0.1% света попадающего на поверхность океана. Чтобы компенсировать недостаток, зооксантеллы производят больше фотосинтезирующих пигментов, например хлорофиллов, а скелет коралла служит сборщиком света, отражая его так, чтобы зооксантеллы эффективно его использовали (Enriquez et al. 2005). Кораллы настолько чувствительны к видимому свету, что могут замечать его при интенсивности всего 0.002 µmol m-2 s-1 , что позволяет им чувствовать солнечный свет на большой глубине и слабый лунный свет на мелководье(Gorbunov et al. 2002. И наконец, глубоководные кораллы могут питаться планктоном, детритом и растворённой органикой, компенсируя недостаток питательных веществ, получаемых при фотосинтезе (Anthony and Fabricius 2000; Titlyanov et al. 2000, 2001a). Дополнительный азот, получаемый с питанием позволяет зооксантеллам существовать при очень слабом освещении (Titlyanov et al. 2000, 2001a).
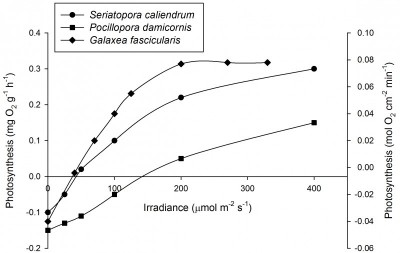
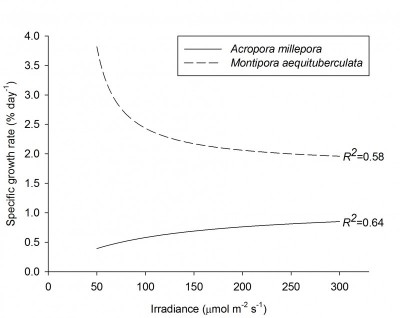
После акклиматизации, уровня освещения в 200-300 µmol m-2 s-1 достаточно для максимальной продуктивности фотосинтеза многих кораллов, например Galaxea fascicularis (Riddle 2007; Schutter et al. 2008, 2011), хотя некоторые виды требуют больше света. Например у Seriatopora caliendrum и Pocillopora damicornis максимум наблюдается при уровне более 400 µmol µmol m-2 s-1. Следует заметить, что эти же виды могут быть акклиматизированы и к более низкому уровню освещения и после акклиматизации их показатели фотосинтеза также будут высокими. К тому же, даже внутри одного вида, каждый генетически уникальный экземпляр может вести себя по-разному. Montipora aequituberculata демонстрирует максимальную скорость роста уже при 40-60 µmol m-2 s-1, тогда как другие близкородственные виды, например Acropora millepora требует для максимальной скорости роста 300 µmol m-2 s-1 (Wijgerde and Laterveer 2013).
Итак, если быть честным, первый миф частично правдив. Большее количество света действительно хорошо для многих кораллов, в смысле поддержания высокого уровня фотосинтеза и скорости роста, но только до определённого предела. То же касается и насыщенности окраски кораллов, а также синтеза зелёных и красных флуоресцентных протеинов и нефлуоресцентных хромопротеинов (D’Angelo et al. 2008; Wijgerde and Laterveer 2013). К тому же, при сильном освещении относительная скорость роста кораллов уменьшается (Schutter et al. 2008; Wijgerde and Laterveer 2013), и они могут быть подвержены стрессам. Особенно при слабом течении, когда уменьшается отвод тепла и образующегося при фотосинтезе кислорода (Finelli et al. 2006, 2007; Fabricius et al. 2006; Mass et al. 2010; Jimenez et al. 2011). Таким образом мы развенчали ещё один миф, связанный с первым — яркие кораллы не обязательно самые счастливые и скорее всего подвержены стрессу, заставляющего их тратить уйму энергии на защитные механизмы, включающие и выработку ярких пигментов.
Скорость фотосинтеза Seriatopora caliendrum (левая ось, N=3), Pocillopora damicornis (левая ось, N=3) и Galaxea fascicularis (правая ось, N=4) при различной интенсивности освещения. При 200 µmol m-2 s-1, фотосинтез насыщен для G. fascicularis. Для ясности, показатели погрешностей опущены. По данным Osinga et al. (2011).
Относительная скорость роста Acropora millepora (N=18) и Montipora aequituberculata (N=18) при различной интенсивности освещения. Период роста — 70 дней. При увеличении интенсивности освещения более 50 µmol m-2 s-1 достигался эффект насыщения для A. millepora и ростозамедляющий эффект для M. aequituberculata (график: T. Wijgerde, по данным Wijgerde and Laterveer 2013).
«Жесткие кораллы требуют больше света, чем мягкие»
Этот миф связан с предыдущим и похоже такой же живучий. Обычно он проявляется в таких фразах: «Если у тебя только мягкие кораллы, 100 ватт света будет достаточно, но если ты хочешь твёрдые, необходимо увеличить свет как минимум вдвое». Во время погружений на коралловые рифы, мы обнаружили, что никаких оснований считать, что твёрдые кораллы более светолюбивы нет. На очень мелководных рифах мы обнаруживаем обе разновидности, растущие рядом. То же самое наблюдается и на глубине более 100 метров, где можно встретить, например, представителей родов Sarcophyton, Lobophyton, Acropora и Leptoseris (Riddle 2007; Bare et al. 2010; Rooney et al. 2010; Bongaerts et al. 2011). Наблюдения в природе подтверждаются в лабораторных экспериментах, где оказывается, что мягким кораллам для максимальных показателей фотосинтеза требуется иногда больший уровень освещения, чем твёрдым (Riddle 2007).
Колонии Sarcophyton и Acropora растут по соседству на рифе в Красном море, Рас Кулан, Египет. Глубина — примерно 3 метра.
Остаётся открытым вопрос, почему этот миф так распространён. Возможно его причина в наблюдаемых изменениях окраски кораллов при уменьшении интенсивности света. Очень часто ярко окрашенные колонии акропор становятся коричневыми через неделю или две, оказавшись в домашнем аквариуме. Причина этого — недостаток света, а иногда избыток неорганического питания, заставляющий зооксантеллы производить больше хлорофиллов и других пигментов в течение нескольких дней подряд (Titlyanov et al. 2000, 2001a,b). Иногда также увеличивается концентрация зооксантелл. В зависимости от вида, этот процесс может продолжаться несколько недель (Kinzie et al. 1984; Titlyanov et al. 2000, 2001a,b). Таким образом, кораллы просто приспосабливаются к меньшему количеству света, увеличивая эффективность механизмов фотосинтеза. И поскольку коричневый цвет менее привлекателен для аквариумиста, чем пурпурный, зелёный, голубой, жёлтый или красный, коралл кажется подверженным стрессу или больным. В действительности кораллы прекрасно способны адаптироваться, а наши запросы и представления мешают нам понять жизнь этих удивительных животных.
«Свет голубых оттенков естественней и лучше для кораллов»
Несмотря на то, что сейчас над аквариумами светятся светильники самых разных типов, большинство из них имеют общую черту — преобладание голубого спектра. Большинство любителей предпочитают преобладание голубого света в морских аквариумах, подчёркивающего флуоресцентные свойства населяющих их обитателей, в то время как в растительных пресноводных аквариумы свет чаще всего жёлтого оттенка. Такая дихотомия голубого и жёлтого считается естественной и полезной для кораллов и морской рыбы. Голубой цвет действительно более приятен с эстетической точки зрения, но источники света с сильным уклоном в голубизну не являются ни естественными, ни необходимыми кораллам. Если мы посмотрим, как морская вода изменяет спектральный состав солнечного света, мы обнаружим, что на глубине до 10 метров присутствуют все составляющие видимого спектра. После 10 метров быстро исчезает красная составляющая исчезает, оставляя голубовато-зелёные оттенки, так знакомые дайверам. Это значит, что «жёлтые» лампы, которые испускают широкий спектр, включая голубую и красную составляющие, и естественны, и полезны для аквариума с кораллами. Всё зависит от того, какую часть водного столба мы хотим воспроизвести. Действительно, некоторые кораллы предпочитают голубой свет, но большинство лучше растут при более сбалансированных и источниках света с полным спектром (Wijgerde and Laterveer 2013). Многие кораллы, такие как представленная на фото колония Montipora, являются обладателями зеленых тканей, интенсивно флуоресцирующих под голубым и фиолетовым светом, благодаря чему синие источники света стали невероятно популярны
«Чем сильнее течение, тем лучше кораллам»
И опять, стоит признаться, этот миф частично является правдой. Хорошее течение положительно влияет на скорость роста, фотосинтез, дыхание, обновление покровов, удаление отходов жизнедеятельности и питание (Wijgerde 2013b). Правда, понятие «слишком много», также часто относится к течению и известно многим аквариумистам. Например, нахождение коралла возле выхлопа трубы может повредить его мягкие ткани. И к тому же при избытке течения полипы могут деформироваться так, что не сиогут питаться планктоном (Dai and Lin 1993; Wijgerde et al. 2012b).
Большинство кораллов хорошо себя чувствуют и питаются при скорости течения между приблизительно 5 и 25 см/c. Некоторые виды требуют более тщательного подбора параметров, например горгонарии Acanthogorgia vegae, Melithaea ochracea и Subergorgia suberosa (Dai and Lin 1993), нефотосинтезирующие твёрдые кораллы Lophelia pertusa (Purser et al. 2010) и восьмилучевые кораллы рода Dendronephthya (Fabricius et al. 1995). Подробности подбора течения для этих видов можно посмотреть у Wijgerde (2013a).
У Plerogyra sinuosa полипы с крупными, мясистыми щупальцами, которые легко повреждаются при слишком интенсивном течении
«Добавки микроэлементов (trace elements) необходимы для поддержания цвета и здоровья кораллов»
Этот миф поддерживается только частью аквариумного сообщества. На рынке сейчас присутствует огромный выбор добавок для морских аквариумов, включая макроэлементы (кальций, магний, калий), регуляторы pH и щёлочности, микроэлементы и органические добавки (например, аминокислоты). И несмотря на то, что научно доказана полезность некоторых из этих добавок, не всегда они неодходимы для цвета и здоровья. В наше лаборатории по исследованию кораллов в Вагенингенском университете, некоторые аквариумы более двух лет прекрасно существовали без каких либо добавок микроэлементов, и кораллу в них прекрасно себя чувствовали. В аквариумах подменивалась вода, 10% еженедельно, и добавлялся карбонат кальция и гидрокарбонат натрия, для поддержки уровня кальция и щёлочности. Подмены воды помогают поддерживать стабильную концентрацию магния, калия и различных микроэлементов. Регулярное кормление науплиями артемии обеспечивает кораллы протеинами и прочими органическими компонентами. Такой методики достаточно для большинства аквариумов, так как значительная часть марок солей богата микроэлементами в количестве превышающем (и даже сильно) естественные показатели.
Конечно, некоторые аквариумы могут быть так населены кораллами, что регулярной подмены воды недостаточно. В таком случае добавки нужны, но также необходимо проводить тщательный анализ воды в специализированной лаборатории. Добавление высококонцентрированных микроэлементов по любому поводу без анализов может нанести вред кораллам и другим беспозвоночным. Тяжёлые металлы и галогены, такие как йод и фтор, иногда добавляемые для улучшения цвета твёрдых кораллов, ядовиты в концентрациях превышающих естественные. И хотя опытные аквариумисты утверждают, что могут по форме, цвету кораллов и степени раскрытости полипов определить, каких элементов не хватает, благоразумно делать добавки только после тщательного анализа.
Концентрированные микроэлементы, используемые иногда для усиления окраски кораллов, подвергают риску жизнь в аквариуме
Хорошим примером может служить коралловая ферма в Нидерландах, где около 3 тысяч кораллов выращивались в двух 12 тонных бассейнах. После года выращивания без подмен воды, логично было бы предположить, что необходимы добавки многих элементов. Но после лабораторного анализа оказалось, что концентрация многих элементов превышает естественный уровень (согласно Spotte 1992). Среди этих элементов — калий, барий, кадмий, кобальт, хром, медь, железо, лантан, свинец, сурьма и олово (Wijgerde 2012). Подобные наблюдения проводились и в лаборатории Вагенингенского университета, где в разных аквариумах концентрации разных элементов отличались от естественного уровня. Хотя производители аквариумных товаров рекомендуют добавлять микроэлементы в аквариумы, абсолютно ясно, что без анализа невозможно определить какого или каких элементов не хватает. К тому же бактерии и водоросли могут поглощать из воды избыток некоторых элементов, ускоряя свой рост (Martin and Knauer 1973), и, похоже, во многих домашних аквариумах наблюдается передозировка токсических элементов. Хорошими методами для определения состава аквариумной воды являются ICP-AES and ICP-MS, которые позволяют точно определить состав и концентрацию макро- и микроэлементов.
«Кораллы перестают расти и погибают при высоком уровне нитратов и фосфатов»
Уровень питательных веществ в аквариуме — тема интересная, широко обсуждаемая, и мнения по ней всегда расходятся. Три довода за поддержания низкой концентрации питательных веществ — кораллы становятся коричневыми, повышенный рост нежелательных водорослей и низкие концентрации питательных веществ в воде, омывающей коралловые рифы. Объясняя, что происходит с кораллами при высоком уровне азота или фосфора необходимо отличать влияние питательных веществ на физиологию и на экологию.
Для изучения эвтрофикации (избытка питательных веществ), во многих экспериментах повышалась концентрация азота до 20 µmol L-1 (что равно 1.24 mg L-1 нитратов). Для фосфора эти значения составляли 2-3 µmol L-1 (или 0.28 mg L-1 ортофосфатов). Такое повышение концентрации не убивало, но подавляло рост многих кораллов (Marubini and Davies 1996; Ferrier-Pages et al. 2000; Tanaka et al. 2007; Hylkema et al. 2014), причиной чему были изменения в физиологии кораллов. Несколько теорий пытаются объяснить этот эффект. Среди них отравление кристаллами фосфатов, когда кристаллы мешают росту скелета (Dunn et al. 2012), возрастающая конкуренция между кораллами и зооксантеллами за гидрокарбонаты и CO2 (Allemand et al. 2004), и уменьшение поступления в ткани кораллов продуктов фотосинтеза зооксантелл (Falkowski et al. 1993; Stambler 2011). Более вероятной причиной выглядит конкуренция за гидрокарбонаты и CO2, так как плотность зооксантелл при избытке неорганического питания возрастает и они требуют больше ресурсов для фотосинтеза (Muscatine et al. 1989; Dubinsky et al. 1990; Stambler et al. 1991; Falkowski et al. 1993; Marubini and Davies 1996; Titlyanov et al. 2000). И действительно, добавки гидрокарбонатов предотвращают подавление роста при эвтрофикации (Marubini and Thake 1999).
Не самая подходящая среда, с общепринятой точки зрения, — в аквариуме много фосфатов (около 2 mg L-1) и заросли айптазии. Однако, кораллы растут хорошо, несмотря на то, что в результате недостаточно сильного течения частично повреждены внутренние части колоний
За физиологическими эффектами эвтрофикации следуют экологические, когда кораллы обрастают водорослями, происходит затенение в результате планктонных вспышек, а обитатели рифа угнетены вследствие недостатка кислорода (Guzman et al. 1990; Fabricius et al. 2005; Mumby and Steneck 2008; Bauman et al. 2010). Когда в аквариуме достаточно растительноядной живности и хорошая фильтрация, повышение концентрации азота и фосфора не так губительно, как кажется многим аквариумистам. И, хотя, избыток нитратов и фосфатов действительно может подавлять рост кораллов, изменять их цвет и благоприятствовать росту водорослей и цианобактерий, он не является прямой причиной их гибели.
«Термины LPS и SPS имеют значение для классификации»
Пытаясь найти определение для терминов LPS и SPS мы обнаружим, что они являются сокращениями или аббревиатурами. LPS — это сокращение для Large Polyp(ed) Stony или крупнополипных твёрдых кораллов, а SPS для Small Polyp(ed) Stony или мелкополипных твёрдых кораллов. Считается, что у LPS более массивные мягкие ткани, сравнительно с SPS, также распространён стереотип, что их легче содержать. Похоже такое мнение появилось в 1980-х годах, когда некоторые виды LPS кораллов жили в аквариумах дольше или умирали медленней, чем представители родов Acropora и Montipora (SPS). И хотя можно согласиться, что термины LPS и SPS позволяют различать не совсем похожие группы кораллов, научной обоснованности для таких различий не хватает. Оба термина достаточно субъективны. Опытные аквариумисты часто говорят, что крупнополипные — это те кораллы у которых диаметр полипов больше 4 см. Но тогда многие роды считающиеся сейчас LPS, например, Blastomussa, Acanthastrea или Caulastraea не входят в эту группу, остаются только Fungia, Scolymia и Cynarina. Размер полипов не может использоваться для классификации, лучшие результаты дают изучение строения скелетов и анализ ДНК. И к тому же размер не может ничего сказать, в каких условиях коралл рос и какие условия ему нужны в аквариуме.
Euphyllia spp. в аквариумистике классифицируются как LPS кораллы
«По форме и цвету можно определить видовую принадлежность коралла»
Вслед за мифом о LPS и SPS идёт вера в то, что разные виды хорошо различаются по форме и цвету. Это опять заблуждение. Фенотип, или внешний вид, коралла зависит от множества факторов, включая течение и свет. В природе кораллы очень пластичны и могут менять свою форму приспосабливаясь к окружающим условиям. Хороший пример фенотипической пластичности — Pocillopora damicornis. Этот вид образует множество морфотипов (Veron 1995; Schmidt-Roach et al. 2014) На вершинах рифов P. damicornis образует толстые ветви, по всей видимости, чтобы противодействовать течению. На глубине или в лагунах его ветви тоньше и изящней.
Кроме того кораллы из рода Pocillopora образуют новые ветви в основном со стороны течения и там где течение постоянно их колонии вырастают ассиметричными (Chindapol et al. 2013). Таким образом, форма коралла определяется не только видовой принадлежностью (и генной программой), но и внешней средой. Цвет, как было замечено выше, также меняется в зависимости от света и качества воды и является не лучшим параметром для определения. К тому же каждый экземпляр генетически специфичен, что порождает множество цветовых вариаций.
Вариации морфологии коралла Pocillopora verrucosa при различных режимах течения.
Чтобы ещё сильнее запутать вопрос, кораллы иногда образуют межвидовые гибриды, дающие плодовитых потомков (Marti-Puig et al. 2014). Как правильно определить вид и классифицировать кораллы? Долгие годы систематика кораллов основывалась на морфологии скелетов, например на строении и структуре септ и колумелл (Richmond and Wolanski 2011). Появление молекулярной генетики улучшило наше понимание систематики кораллов и внесло изменения в классификацию. В последнее время систематика многих групп пересмотрена согласно генетическим данным (Budd et al. 2012). Например, род Galaxea, входивший ранее в семейство Oculinidae, был перенесён в семейство Euphylliidae. Ещё один яркий пример — Trachyphyllia geoffroyi, бывший единственным представителем семейства Trachyphylliidae, сейчас перенесён в Merulinidae. Микроморфология кораллов продолжает использоваться для систематики, но совместно с данными молекулярной генетики (Marti-Puig et al. 2014).
У зоантусов (отряд Zoanthidea/Zoantharia, подкласс Hexacorallia) полипы могут быть самой разной окраски, и
необходимо проведение анализа ДНК для правильной идентификации.
«Популярные названия лучше научных»
Не только неправильные критерии для определения, но и популярные устоявшиеся названия могут быть источниками заблуждений. Часто при использовании разговорных названий считается, что так практичней. Но разговорные имена специфичны для каждого языка и часто имеют несколько синонимов. Главный недостаток популярных названий — отсутствие структуры, позволяющей выразить связь между видами. Именно по этой причине мы настаиваем на постоянном использовании научной номенклатуры. И хотя систематика кораллов постоянно меняется из-за новых данных генетики, и запомнить научные названия по этой причине сложно, она практичней, чем бесчисленные синонимы. Правильно писать научное название таким образом: Род вид, например Acropora millepora (так название не будет перепутано с названием рода гидроидов Millepora). Название должно быть выделено курсивом, род с большой буквы, а вид с маленькой. Когда используется только родовое название к нему добавляется сокращение «sp.» для одного вида и «spp.» для нескольких. Курсивом они не выделяются. Поскольку названия могут меняться, часто после названия пишется фамилия учёного описавшего впервые вид и год описания, например Stylophora pistillata Esper 1797, в скобках или без.
Мы можем использовать научные названия и для других уровней систематики, что позволит нам понять связи между сотнями существующих ныне видов кораллов. Впервые современная система классификации организмов была предложена в XVIII веке Карлом Линнеем. Она представляет собой несколько уровней, где высшая группа объединяет несколько групп (если есть) низшего уровня. Рассмотрим как это выглядит на примере Acropora millepora:
Домен: Eukaryota (клетки содержат ядро) Whittaker and Margulis 1978
Царство: Animalia (животные) Linnaeus 1758
Тип: Cnidaria (Стрекающие, обладают стрекательными клетками) Hatschek 1888
Класс: Anthozoa (Коралловые полипы) Ehrenberg 1834
Подкласс: Hexacorallia (Шестилучевые кораллы) Haeckel 1896
Отряд: Scleractinia (твёрдые (мадрепоровые) кораллы) Bourne 1905
Семейство: Acroporidae (Акропоровые) Verrill 1902
Род: Acropora Oken 1815
Вид: millepora Ehrenberg 1834
С человеком (Homo sapiens), например, Acropora millepora делят одно царство, с настоящими медузами (класс Scyphozoa) — один тип, с актиниями (отряд Actiniaria) и мягкими кораллами (отряд Alcyonacea) — один класс, с чёрными кораллами (отряд Antipatharia) — один подкласс, с фунгиями (семейство Fungiidae) — один отряд, с Montipora spp. — одно семейство и, наконец с Acropora humilis — один род. Согласно данной системе было бы некорректно, например, говорить, что роды Fungia и Acropora относятся к одному семейству, так как они всего лишь в одном отряде. И в то же время термин «группа» всегда правилен, так как два вида кораллов где нибудь на таксономическом дереве окажутся в одной группе, хотя смысл термина «группа» не всегда понятен.
Что лучше использовать: использовать общепринятые названия, такие как креветочный бычок Рэндалла, оранжевополосый креветочный бычок или просто использовать название Amblyeleotris randalli?
«Планарии встречаются в морских аквариумах»
Это не миф, а всего лишь следствие ошибочной терминологии. Плоских червей в морском аквариуме называют планариями из-за их сходства с представителями семейства Planariidae (отряд Tricladida), и/или рода Planaria. Что характерно, все представители семейства Planariidae — пресноводные обитатели. Все плоские черви, которые живут в морском аквариуме и обитают на кораллах — это или ацеломорфы или многоветвистые плоские черви. Так что термин «плоский червь» более корректен чем «планария».
Ацеломорфы лишены полости тела и переваривают добычу так называемым синцитием, группой взаимосвязанных клеток. В аквариумах встречаются представители семейства Convolutidae, принадлежащие к отряду Acoela, статус которого пока не ясен, типу Acoelomorpha (WoRMS 2013). Виды, часто замечаемые на кораллах, обычно из родов Waminoa и Convolutriloba, друг от друга они отличаются формой задней части тела, определение же до вида невозможно без анализа ДНК. известно, что Waminoa и Convolutriloba spp. охотятся на зоопланктон (Hendelberg and Akesson 1988; Shannon and Achatz 2007; Wijgerde et al. 2011), и, по крайней мере, Waminoa spp. замечены за паразитизмом, мешая питанию кораллов и воруя у них добычу (Wijgerde et al. 2012a). Контролировать численность плоских червей можно посредством хищников — губанов (например Halichoerus spp.), лировых (например Synchiropus splendidus) и голожаберных моллюсков (Chelidonura varians) (Carl 2008; Nosratpour 2008). Химическая обработка противоглистным левамизолом также даёт хорошие результаты, но её нельзя применять в общем аквариуме из-за возможного ущерба кораллам.
Ацеломорф, скорее всего, Waminoa sp., в аквариуме. Обратите внимание на большое количество зооксантелл на черве, возможно, Symbiodinium или Amphidinium sp.
Многоветвистые турбелярии весьма различны, и относятся к отряду Polycladida, класса Turbellaria. Наиболее известен Amakusaplana acroporae (Prosthiostomidae, Rawlinson 2011), который может уничтожать целые колонии акропор (Nosratpour 2008). В отличие от ацеломорф, замеченных только за поеданием коралловой слизи и зоопланктона, A. acroporae питается мягкими тканями кораллов. Подтверждается хищничество червей и обнаружением нематоцитов кораллов в их пищеварительном тракте (Rawlinson 2011). Многоветвистых турбелярий также можно контролировать с помощью хищников, а также уничтожать при помощи пресной воды (Nosratpour 2008).
«Обесцвечивание — это некроз»
Достаточно часто в аквариумистике кораллы, у которых виден белый арагонитовый скелет, диагностируют как обесцвеченные. Во многих случаях подобный диагноз является ошибочным. Обесцвечивание – это утрата зооксантелл и/или фотопигментов, некроз – это утрата тканей коралла. Поскольку обесцвеченные ткани коралла прозрачны и под ними можно рассмотреть скелет, многие думают, что коралл погибает. В случае некроза у коралл теряет ткани, иногда в след за обесцвечиванием, при этом зооксантеллы иногда продолжают жить. Быстрый некроз тканей, называемый в аквариумистике RTN (rapid tissue necrosis), — это тот случай, когда ткани коралла сбрасываются вместе с зооксантеллами.
Возможными причинами обесцвечивания могут быть слишком интенсивное освещение (Brown et al. 1994; Le Tissier and Brown 1996), слишком высокая температура воды (Lesser et al. 2007) и высокая концентрация зооксантелл (Cunning & Baker 2012). Несмотря на то, что обесцвечивание является сильным стрессом для коралла и зачастую приводит к гибели, кораллы все же способны восстановиться. Если обесцвеченный коралл получает новую популяцию зооксантелл, к нему возращается жизнеспособность (Glynn and D’Croz 1990). Иногда колония становится даже более крепкой и выносливой, чем раньше. Если кораллы обесцвечиваются в результате слишком высокой температуры воды, они демонстрируют так называемое «адаптивное обесцвечивание». Подвергшиеся стрессу зооксантеллы сбрасываются, а коралл принимает более толерантные к температуре зооксантеллы (Baker 2001; Baker et al. 2004; Berkelmans and van Oppen 2006, Mieog et al. 2007; Jones et al. 2008). Достаточно часто такие толерантные к более высокой температуре зооксантеллы уже присутствуют на коралле, но лишь в небольшом количестве. Без конкуренции с менее толерантными к температуре зооксантеллами, более толерантные начинают доминировать. Адаптивное обесцвечивание – еще один пример фенотипической пластичности кораллов, — реакции на изменение условий окружающей среды. Однако, Coffroth et al. (2010) считают, что этого механизма недостаточно, чтобы адаптироваться к воздействию будущих климатических изменений. Удивительно, но кораллы удерживают несколько типов зооксантелл даже спустя несколько лет обитания в неволе, предполагая, что даже в аквариуме может иметь место адаптивное обесцвечивание (Tilstra 2012; Tilstra et al. 2014).
Непосредственной причиной некроза может быть обесцвечивание, когда кораллы не в состоянии получить необходимое им количество планктона, чтобы компенсировать недостаток питательных веществ, обычно поставляемых им зооксантеллами. В процесс могут быть вовлечены и различные патогенные организмы, включая грибки и бактерии (Rosenberg and Ben-Haim 2002; Bourne et al. 2009). Luna et al. (2007) продемонстрировали, что у омертвевших кораллов бактерии Vibrio присутствуют в значительно большем количестве, чем у здоровых экземпляров, соответственно, ученые предположили, что бактерии тоже принимают участие в развитии некроза. Различие между обесцвечиванием и некрозом заключается в том, что у некротических (омертвевших) кораллов совершенно четко просматриваются мембраны и пустые кораллиты.
Увеличенный снимок фрагментов Stylophora pistillata в процессе эксперимента с обесцвечиванием. Слева: здоровый коралл. По центру: этот же коралл, практически полностью обесцвеченный. Справа: другой коралл, прaктически полностью омертвевший. Обратите внимание на просматривающиеся мембраны и пустые кораллиты
Для борьбы с обесцвечиванием необходимо нейтрализовать возможную причину. Например, кораллы, обесцвеченные в результате чрезмерного освещения или перегрева, могут восстановиться в течение нескольких недель, если уменьшить интенсивность света и температуру. Для восстановления омертвевших кораллов необходим другой подход. Если у коралла проявляется некроз, спасти колонию можно, удалив поврежденный участок, желательно захватив край неповрежденных тканей.
«Зооксантеллы и диатомовые — это растения»
Этот миф способен сбить с толку и аквариумистов, и ученых, что отчасти связано с гибкостью терминологии. Зооксантеллы (класс Dinophyceae, или динофлагелляты) и диатомовые (класс Bacillariophyceae) можно назвать и одноклеточными животными с признаками растений, и одноклеточными растениями с признаками животных. При объяснении симбиоза между кораллами и зооксантеллами, ученые зачастую называют зооксантеллы миниатюрным растениями. В действительности, растения относятся к отдельному царству, Plantae, при этом, ни зооксантеллы, ни диатомовые не принадлежат к этому царству. Также как они не являьтся бактериями. На самом деле, эти одноклеточные организмы больше напоминают клетки человека, чем бактериальные клетки. У бактерий отсутствует ядро, они принадлежат к домену Prokaryota, тогда как зооксантеллы и диатомы принадлежат к домену Eukaryota. Недавние изменении в классификации перенесли и динофлагеллят, и диатом в царство Chromalveolata, хотя раньше они относились к Protista (протисты или простейшие). Впрочем, ученые до сих пор предпочитают использовать термин Простейшие.
Большинство динофлагеллят и диатомовых являются фотосинтетическими организмами, что роднит их с настоящими растениями. Растения, преимущественно, являются многоклеточными, тогда как простейшие — это одноклеточные организмы или колонии клеток. Более того, стенки клеток протистов отличаются от стенок клеток растений. Например, диатомовае заключены в пористый кремниевый панцирь, форма которого может быть совершенно разной. Более того, простейшие способны передвигаться. У динофлагеллят имеются жгутики или реснички, которые используются для «плавания», а у донных диатомовых имеется шов, или рубец, для «ползания». Обе группы простейших известны своей способностью создавать проблемы в морских аквариумах. При подходящих условиях, они очень активно растут, создавая толстый, неприятный слой, покрытый пузырьками кислорода, полученного в результате фотосинтеза. Вопреки распространенному мнению, динофлагеллятам для роста не требуются силикаты (Tuttle and Loeblich 1975), которые необходимы только диатомовым и некоторым другим простейшим.
Наиболее знакомые нам динофлагелляты – это зооксантеллы (род Symbiodinium), живущие в симбиозе с кораллами, двустворчатыми и голожаберными моллюсками, плоскими червями и фораминиферами (Pawlowski et al. 2001; Venn et al. 2008). В настоящее время выделены девять филогенетических клад (от A до I) (Wagner et al. 2011). Каждая клада подразделяется на субклады. Шесть клад ассоциируются преимущественно с рифообразующими или мадрепоровыми кораллами (клады A до D, F и G), при этом, клады A до D встречаются наиболее часто (Baker 2003; Pochon 2006). На кораллах обычно обитает один доминантный тип зооксантелл (Coffroth et al. 2001) и несколько других типов в меньшем количестве (Goulet and Coffroth 2003). Характеристики клад и типов существенно отличаются. Например, клада D известна как наиболее толерантная к температуре (Rowan 2004), тогда как клада C1, судя по всему, лучше переносит слабое освещение по сравнению с типом C2 (Ulstrup and van Oppen 2003).
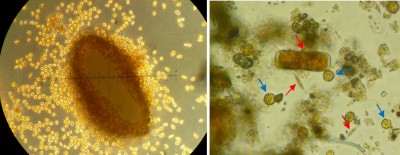
И динофлагелляты, и диатомовые могут входить в состав микрофитобентоса, слоя простейших, водорослей и бактерий на дне озера, океана или аквариума. В сообществе микрофитобентоса обычно доминируют диатомовые (Admiraal 1984; Yallop et al. 1994). Вместе с бактериями это сообщество обычно называется перифитоном. Диатомовые образуют микробную биопленку, состоящую из внеклеточных полимеров (Extracellular Polymeric Substances, EPS), углеводных выделений, которые обеспечивают склеивание и стабильность слоя (Hoagland et al. 1993). Углеводные выделения также используется в качестве источника пищи бактериями (Middelburg et al. 2000). В образцах детрита и микрофитобентоса из нашего лабораторного аквариума в Гронингенском университете были обнаружены диатомовые и динофлагелляты, а также фораминиферы и спикулы губок. Слева: крупинка кораллового песка, окруженная динофлагеллятами, 100 кратное увеличение, образец взят из пораженного водорослями аквариума. Справа: макроснимок частицы детрита из лабораторного аквариума, 100 кратное увеличение. Рядом с органическим материалом диатомовые (красные стрелки) и динофлагелляты (синие стрелки)
«Пеноотделитель необходим для поддержания здоровья кораллов и рыб»
Следует признаться, что скиммер, или пеноотделитель, — это та инновация, которая позволила достичь нынешних успехов в содержании кораллов. В настоящее время, в большинстве морских аквариумов установлен скиммер в качестве главного элемента фильтрации, которая иногда дополняется УФ и биофильтрами. Иногда аквариумисты спорят, что без скиммера невозможно поддерживать кораллы и рыб здоровыми. Несмотря на сложности, все же нельзя утверждать, что это невозможно. Существуют альтернативы пеноотделителю, хотя зачастую эти варианты считаются неэффективными, непредсказуемыми и трудоемкими. Речь идет о глубоком песчаном слое (Deep Sand Bed, DSB), в котором гетеротрофные бактерии удаляют азот, скраберах (Algal Turf Scrubber, ATS), в которых азот и фосфор удаляется с растущими водорослями, серных реакторах, в которых автотрофные бактерии удаляют азот и DyMiCo (Dynamic Mineral Control), более современном, управляемом при помощи компьютера варианте DSB с впрыскиванием углерода. Некоторые аквариумы работают без какой-либо активной фильтрации и зависят только от регулярных подмен воды. Как правило, такие системы небольшие (очень маленькие), поэтому подмены большого объема воды в них вполне реальны и выполнимы. Несмотря на то, что скиммер не является обязательным, его установка рекомендуется как вариант фильтрации для систем с большим количеством обитателей и минимальным обслуживанием.
Этот 500-литровый (132 US галлона) аквариум со здоровыми кораллами соединен с резервуаром с установленным в нём DyMiCo реактором. За исключением небольшого количества цианобактерий на задней панели, этот аквариум выглядит отлично
----------
Несмотря на то, что общий тон статьи может показаться иногда снисходительным, мы надеемся, что издоженная информация поможет лучше понять жизнь наших морских аквариумов. Мы считаем, что элементарные научные знания и несколько скептичное отношение помогут вам добиться успеха в аквариумистике. И наконец, мы все должны быть открыты для новых идей, но при этом относиться скептично к заявлениям, не основанным на реальных фактах.
Источник: zoologiafantastica.com