Томми Дорнхоффер рассказывает о всех тонкостях азотного цикла в морском аквариуме
Азот — это один из наиболее часто обсуждаемых, а возможно, единственный часто упоминаемый химический элемент домашнего аквариума. При этом, будучи далеко не единственным элементом, интересующим рядового рифового аквариумиста, азот является одним из первых элементов, с которого начинается изучение аквариумистики, а классический азотный цикл лежит в основе многих методов обслуживания аквариума. Столь повышенное внимание является вполне заслуженным,так как азотные соединения, в особенности, нитраты (NO3), оказывают регулирующее воздействие на функционирование как естественной, так и домашней рифовой экосистем. Большинство рифовых аквариумистов активно интересуются воздействием концентрации нитратов на рост водорослей, при этом много внимания уделяется регулированию концентрации нитратов и уменьшению таким образом роста назойливых микроводорослей. В целом, азот часто считается лимитирующим фактором, влияющим на первичную продуктивность, и хотя во многих домашних аквариумах это правило не всегда работает, контроль над нитратами остается одним из наиболее эффективных способов влияния на первичную продуктивность в наших системах.
Несмотря на важную роль азота в домашнем аквариуме, многие аквариумисты лишь обобщённо понимают процессы, регулирующие преобразование и концентрацию азотных соединений. Многие аквариумисты знают об азотном цикле лишь то, что в процессе окисления аммония (NH4) образуются нитраты, которые затем восстанавливаются в газ азот (N2). И хотя подобное понимание динамики азота в аквариуме нельзя назвать неверным, в данном случае упускается из виду сложность азотного цикла, особенно в плане влияния на него других факторов, действующих в наших аквариумах. На первый взгляд, многие дополнительные факторы могут показаться не столь важными, но я готов возразить, что понимание их влияния на азотный цикл не только позволяет раскрыть, как работает аквариумная система, но и помогает нам стать более успешными аквариумистами.
В данной статье я хотел бы подробно рассказать об азотном цикле домашнего аквариума и обсудить факторы, оказывающие влияние на скорость и масштаб этих процессов. Я подробно рассмотрю факторы, влияющие на скорость денитрификации, с учетом большого значения этого процесса для выведения азота из системы. Кроме того, я расскажу о взаимосвязи азотного цикла с песчаным грунтом аквариума и о родственных концепциях биоирригации и биотурбации, которые обязательно необходимо принимать во внимание при разработке естественного и здорового рифового аквариума. Наконец, я расскажу о значении углерода в системе и поделюсь практическими рекомендациями по снижению устойчивой высокой концентрации нитратов, расскажу и о других способах применения углерода для аквариумных экосистем.
Азотный цикл
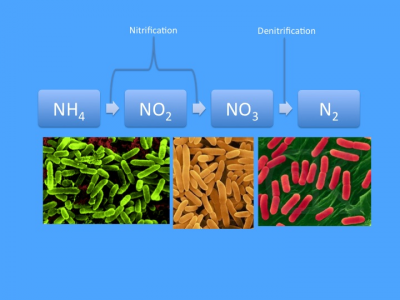
В самом упрощённом варианте (продемонстрированном на Рис. 1) азотный цикл представлен в виде простой линейной последовательности реакций в которой аммиак (NH3) окисляется до нитрита (NO2), а затем нитрата, который впоследствии восстанавливается в газообразный азот (N2), который, в свою очередь, выводится из аквариума в виде пузырьков и представляет собой «сточную трубу» для вывода азота. Последний этап осуществляется только в бескислородных условиях (т.е. на участках где кислород отсутствует), но все остальные этапы азотного цикла, по сути, указаны верно. И хотя такая схема представляет собой лишь упрощённое понимание сложной динамики морского азота, для большинства аквариумистов-любителей этой простой концепции вполне достаточно для повседневного ухода за аквариумом. Однако, цельная картина значительно сложнее и, честно говоря, не может рассматриваться без учета других элементов; например, основное условие, что денитрификация проходит на бескислородных участках, означает, что нам также необходимо принимать во внимание динамику кислорода в аквариуме. Более того, помимо превращения растворенных неорганических азотных соединений (dissolved inorganic nitrogen, DIN), указанных выше, мы также должны учитывать органические источники и возможные органические способы выведения азота.
Рисунок 1: Классический азотный цикл в представлении большинства аквариумистов состоит из аммония, окисляющегося двумя группами бактерий (Nitrosomonas и Nitrobacter) до нитратов, которые затем под воздействием других бактерий (Azomonas) превращается в газообразный азот, который в виде пузырьков выходит из системы.
Источники азота в морском аквариуме
Один из основных источников азота в домашнем аквариуме – органический азот, либо в виде частиц (particulate organic nitrogen, PON), либо в виде растворённых азотсодержащих молекул (dissolved organic nitrogen, DON). Единственная разница между этими двумя источниками заключается в том, являются ли они крупными белковыми молекулами, или более мелкими растворимыми молекулами, например аминокислотами. В нашем случае мы можем рассматривать обе группы как взаимозаменяемые; переход из PON в DON проходит достаточно быстро, кроме того, микробы, ответственные за азотный цикл напрямую могут оказывать воздействие на PON (Kristensen et al. 1987, Berg et al. 2003).
Органический азот может попадать в аквариум несколькими способами. Любой корм (для рыб, беспозвоночных или всего аквариума в целом) содержит большое количество белков, аминокислот и т.п., благодаря чему азот попадает в аквариум. И хотя некоторые корма сразу же и напрямую включаются в азотный цикл, большинство кормов подключаются к процессу в виде побочных продуктов пищеварения, в виде органических отходов (или целых клеток, как в случае микробов). Далее, эти отходы расщепляются в процессе диагенеза, частью которого является азотный цикл, о котором мы поговорим далее.
Помимо прямого попадания в виде пищи, органический азот может поступать в систему как продукт связывания азота. Связывание азота – процесс, когда отдельная группа организмов (которые называются азотфиксаторами) превращают газообразный азот в аммоний, который в дальнейшем обычно используется азотфиксирующими организмами для их роста. Разумеется, когда организм умирает, этот азот поступает в систему; соответственно, это очень важный источник N. В целом, связывание азота – очень важный процесс, регулирующий эффективность многих океанических систем (Gruber et al. 1997), но, к сожалению, в настоящее время неизвестно, в какой степени связывание азота имеет место в домашнем аквариуме. Известно, что этот процесс протекает на коралловых рифах (Larkum et al. 1988), но неизвестно, фиксируют ли азот цианобактерии в домашнем аквариуме при нормальных условиях. Любопытно, но я лично наблюдал гетероцисты (азот-связывающий «орган» у цианобактерий) в микроскопических образцах, полученных из моего собственного аквариума, поэтому вполне можно предположить, что азотфиксация является источником азота и в аквариуме.
По мере попадания в систему в виде PON или DON, в домашнем аквариуме азот неизменно потребляется в той или иной форме, о чем мы поговорим далее. В природе, большие массы PON оседают в грунте, но в аквариуме для этого не хватает скорости осадконакопления и глубины грунта. Наоборот, весь органический азот в наших системах будет включаться в процесс диагенеза, — разложения, свойственного всем органическим веществам.
Реминерализация и нитрификация в морском аквариуме
Соединения, содержащие органический азот, как правило, также содержат органический углерод, который может быть органическим углеродом в частицах (POC) или растворенным органическим углеродом (DOC). Несмотря на то, что все гетеротрофные организмы питаются этими соединениями (многим автотрофным организмам необходимы, по крайней мере, некоторые из их компонентов), клеточный механизм обмена веществ способен усваивать только маленькие частицы, составляющие макромолекулы, например аминокислоты. Поэтому, первый этап диагенеза – это расщепление крупных сложных органических молекул на составляющие частицы; процесс называется реминерализацией; в общем виде он выглядит следующим образом:
(CH2O)x(NH3)y + xTER + yH+ —> xCO2 + yNH4+ + xH2O
Я использовал «TER» для указания на терминальный акцептор электронов, при этом x и y обозначают состав органического вещества. Обычно эти показатели 106 и 16, соответственно, и демонстрируют известную пропорцию Редфилда соотношения этих элементов в планктоне. Тем не менее, многие аквариумные корма отличаются от этого соотношения, поэтому я оставил уравнение в общей форме. Но больше всего нас интересует аммоний, получаемый в результате этой реакции. Этот аммоний – первое вещество, которое затем участвует в классическом азотном цикле.
Необходимо отметить, что в отличие от других процессов, которые мы обсудили и еще будем обсуждать, реминерализация проводится каждым организмом, присутствующим в аквариуме (и нами, использующими O2 в качестве терминального акцептора электронов), соответственно, этот процесс постоянно протекает в наших аквариумах, обычно производя большое количество аммония. К счастью, большая часть этого аммония используется для роста организмов (Herbert 1999, Fennel et al. 2006), хотя при этом значительное количество включается в процессы нитрификации азотного цикла.
Нитрификация – это процесс, посредством которого аммоний, полученный в результате реминерализации, окисляется до нитрата. Это двухэтапный процесс, где нитрит (NO2) выступает в качестве промежуточного звена, и он обычно выполняется группами бактерий, при этом одна группа выделяет нитриты, а другая группа потребляет и окисляет их. Из этих двух этапов, первый (окисление аммония) очень медленный, поэтому наличие нитритов в домашнем аквариуме редко определяется после того, как в системе установились популяции бактерий. Нитраты, появившиеся в результате этого процесса, могут включаться в биомассу, но подавляющее большинство принимает участие в процессе, который зачастую больше всего волнует аквариумистов, — денитрификации.
Денитрификация в морском аквариуме
Денитрификация – это гетеротрофный процесс (что означает, что участвующие в процессе организмы должны потреблять больше углеродных соединений, чем они сами производят), который превращает нитраты в газообразный азот и может быть представлен в виде следующего уравнения:
(CH2O)106(NH3)16 + 85NO3 + 100H+ —> 106CO2 + 16NH4+ + 43N2 + 149H2O
(Пожалуйста, обратите внимание, что уравнение несколько несбалансированно, потому что я округлил десятые доли стехиометрических коэффициентов).
Общий результат этого уравнения – удаление достаточно большого количества азота в виде газа. В целом, мы получаем возможность управлять первичной продуктивностью (которая потребляет азот), а в аквариуме этот процесс – один из наиболее эффективных способов, при помощи которых мы можем выводить азотсодержащие соединения, содержание которых может быть чрезмерным. Несмотря на то, что этот процесс подробно рассматривается в аквариумной литературе, думаю, самое важное для нас на данном этапе — понимание того, что для проведения этого процесса необходимы органические вещества. Это очень важный момент и я ещё вернусь к нему.
Дополнительные процессы, влияющие на азот в морском аквариуме
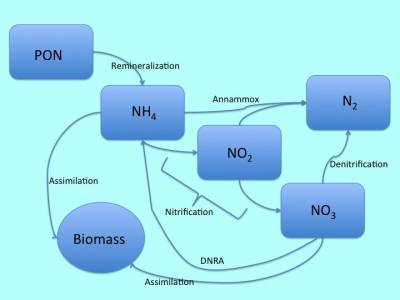
Несмотря на то, что описанные выше процессы представляют собой практически полный перечень того, что может происходить в наших системах, в естественной среде все ещё сложнее. В частности, могут иметь место два дополнительных процесса, о которых стоит упомянуть для полноты картины. Необходимо отметить, что эти процессы являются относительно новыми для научного сообщества, поэтому в настоящее время они ещё не до конца поняты и изучены.
Один относительно недавно открытый процесс, влияющий на круговорот азота в естественной экосистеме – анаэробное окисление аммония, больше известное как аннаммокс (anaerobic ammonium oxidation = annammox). В рамках этого процесса, определённые анаэробные бактерии и археи способны значительно сократить обычный азотный цикл, в результате чего образуется газообразный азот образуется непосредственно из аммония и нитритов. Подобный процесс представляет собой, возможно, очень важную альтернативу вывода азота (Engstrom et al. 2005), но до сих пор неясно, при каких условиях этот процесс преобладает. Наиболее часто этот процесс встречается на участках океана, где низкий уровень содержания кислорода сочетается с низким уровнем содержания органического углерода, что нехарактерно для типичного аквариума. В условиях, более типичных для наших систем, annammox значительно реже встречается и поэтому, скорее всего, не является важным аспектом цикла (Porubsky et al. 2009).
Еще один относительно «новый» процесс называется диссимиляционным восстановлением нитратов до аммония, или DNRA. Несмотря на сходство с традиционной денитрификацией, этот процесс представляет собой способ, при помощи которого организмы перерабатывают нитраты, а не оставляют их для вывода из системы. К счастью для нас, DNRA доминирует в осадочной породе с высоким содержанием сернистых соединений (Porubsky et al. 2009), что нехарактерно для большинства рифовых систем.
Рисунок 2: Развернутая версия азотного цикла, включающая источники азота, а также относительно недавно открытые процессы DNRA и annammox.
Азот и песчаный грунт в морском аквариуме
Обсуждение азотного цикла практически невозможно без обсуждения песчаного грунта в аквариуме, потому что именно в песчаном слое протекает большинство процессов. Разумеется, карбонатная матрица живых камней также является привлекательной для очень активного микробного сообщества, о чем мы поговорим параллельно с обсуждением песчаного слоя.
Несмотря на тот факт, что наличие песчаного слоя является спорным вопросом, я мог бы оспорить утверждение, что присутствие песчаного грунта является необходимым условием естественного азотного цикла (пожалуйста, обратите внимание, что я не утверждаю, что поддержание естественного азотного цикл является единственным эффективным условием содержания аквариума). Многие аквариумисты могут не согласиться со мной в этом вопросе; многие считают, что песчаный грунт приносит больше вреда, чем пользы в долговременной перспективе. Отчасти это связано с недостаточным пониманием процессов, протекающих в морском осадке; тем не менее, существуют важные аспекты, которые необходимо принимать во внимание при наличии в системе песчаного слоя; о них мы поговорим далее. Но сначала я должен рассказать о реальных процессах, протекающих в осадочном слое, а в особенности, о способах их участия в азотном цикле.
Окислительно-восстановительный каскад
По всему миру и, особенно, на прибрежных участках, включая коралловые рифы, донные отложения являются основным местом диагенеза и реминерализации, о которых мы говорили выше (Galloway et al. 2004). Одной из причин их доминирования является простой факт, что органические отходы, которые состоят из мёртвых организмов, фекалий и питательного морского снега, оседают и образуют осадочный слой; разложение большей части органических веществ происходит там, где в конечном итоге оказываются органические вещества.
Когда органические вещества оказываются в осадочном слое, сразу же начинается процесс диагенеза. Первое, и самое важное замечание, — органические вещества потребляются и усваиваются при помощи аэробного дыхания, где используется кислород в качестве терминального акцептора электронов («TER» в уравнении 1). Однако, количество органических веществ обычно превосходит количество кислорода, поэтому организмы затем вместо кислорода начинают использовать «запасные» приёмники электронов вместо кислорода. На первом месте среди них – нитраты, посредством денитрификации, которая термодинамически не настолько «прибыльна» для организмов, как аэробное дыхание. Поэтому денитрификация всегда ассоциируется с бедными кислородом осадками или слоями воды: кислород термодинамически – предпочитаемый акцептор электронов, нитраты используются только как запасной вариант.
По мере того, как нитраты и кислород использованы, органические вещества продолжают разлагаться энергетически менее предпочтительными терминальными акцепторами электронов в соответствии с хорошо сложившимся каскадом, продолжая процесс восстановлением железа и, наконец, восстановлением сульфатов. В большинстве случаев, органические вещества потребляются задолго до использования сульфатов, поэтому мы завершим наше обсуждение на этом этапе. В целом, все эти метаболические способы называются окислительно-восстановительным каскадом (redox cascade), понимая под ним каскад менее желательных терминальных акцепторов электронов, при помощи которых гетеротрофные организмы потребляют органические вещества из осадков.
Для большинства аквариумистов, интерес к окислительно-восстановительному каскаду заканчивается восстановлением нитратов, но в качестве дополнительного примечания, я думаю, необходимо вкратце рассказать о восстановлении сульфатов. Один возможный аргумент против использования песчаного грунта заключается в том, что он может способствовать образованию токсичных сульфидов. Однако, данный аргумент игнорирует тот факт, что перед восстановлением сульфатов происходит восстановление железа. А факт этот важен по двум причинам: 1) в морской осадочной породе содержится большое количество железа, поэтому очень маловероятно, что железо будет использовано всё в среде с низким содержанием питательных веществ, характерной для наших аквариумов и 2) любой сульфид, полученный в осадочной породе, будет стремиться к осаждению с железом, полученным в результате восстановления железа и образованию нерастворимого сульфида железа (FeS), соответственно, действуя в направлении удаления любых возможных сульфидов. Разумеется, это достаточно сложная тема, заслуживающая отдельной статьи, поэтому краткого пояснения в данном случае вполне достаточно.
Живые камни и азотный цикл в морском аквариуме
Как я уже говорил выше, живые камни также являются важным местом деятельности микроорганизмов, в том числе, и участвующих в азотном цикле. К сожалению, конкретная динамика не настолько хорошо изучена, как в отношении процессов в песчаном слое, но в плане окислительно-восстановительного каскада применяются те же самые принципы. Основная разница между живыми камнями и песчаным грунтом — простое строение, которое оказывает воздействие на скорость диффузии, процесса, в результате которого поставляется большая часть нитратов и других соединений, усваивающихся в процессе окислительно-восстановительного каскада. Другое важное различие, до сих пор не указанное мной, — возможность биотурбации и биоирригации.
Живые существа в грязи
Для меня, один из наиболее привлекательных аспектов аквариумистики – не обитатели, которых я покупаю и запускаю в систему, а те случайные поселенцы, которые ненамеренно оказались в моем аквариуме либо вместе с купленными экземплярами, либо попавшие в систему с живыми камнями. Однако, значение этих организмов выходит за рамки простого любопытства: как правило, эти организмы ответственны за некоторые сложно связанные процессы, которые играют ведущую роль в азотном цикле: биотурбацию и биоирригацию. Несмотря на то, что эти процессы технически различаются, их практически невозможно отличить друг от друга, при этом, зачастую у некоторых организмов эти процессы протекают одновременно.
Последняя идея Дарвина
Хотя не столь известная, как теория эволюции, биотурбация, как феномен, была впервые описана Чарльзом Дарвиным в одной из его последних работ (Meysman et al. 2006). Если коротко, то «биотурбация» – это термин, описывающий коллективные действия роющих организмов, что приводит или усиливает физическое перемешивание осадочной породы. Связанная с этим процессом «биоирригация» является термином, описывающим любое активное вентилирование нор или окружающих их осадков организмами, обитающими в этих норах. Оба процесса играют жизненно важную роль в прибрежных и бентических системах, вплоть до того, что такие организмы считаются «инженерами экосистем», т.е. организмами, чьё присутствие оказывает формирующее воздействие на окружающую их экосистему (Jones et al. 1994).
Одним из наиболее важных способов, при помощи которых инфауна (организмы, обитающие в осадочном слое) выстраивает свою среду – образование нор в осаждениях (примеры приведены на Рис. 3). Такие норы значительно увеличивают поверхность соприкосновения осадков с водой (sediment-water interface, SWI), поверхность, вдоль которой проходит обмен растворенных веществ, таких как азотистые соединения. Этот процесс обмена выступает в роли важного канала «коммуникации» между прибрежными водами и слоем осадков, который выступает в качестве естественного фильтра. Что ещё важнее, эти норы, как правило, простираются в бескислородные зоны, и соответственно, служат в качестве важных источников кислорода для нитрификации. На более поздних стадиях азотного цикла, наличие кислородных зон благодаря присутствию нор в бескислородном слое стимулирует так называемую «двойную денитрификацию», которая, по сути, представляет собой денитрификацию, стимулированную нитратами, которые были только что получены в результате нитрификации (Kristensen et al. 1987).
Помимо простого увеличения площади поверхности для диффузионного обмена, активная ирригация нор зачастую активно поставляет и кислород, и нитраты для использования как в процессе нитрификации, так и денитрификации с значительно большей скоростью, чем в случае молекулярной диффузии (Henriksen et al. 1983, Huettel 1990 и многие другие). Это может привести к тому, что скорость денитрификации будет значительно выше, чем скорость процесса в «пустом» грунте, кроме того, эти организмы действительно могут быть ответственны за восстановление экосистемы после периодов азотной эвтрофикации (Bartoli et al. 2000). С физической точки зрения, деятельность биоирригационных и биотурбационных организмов действительно способна регулировать физическое состояние грунта (Volkenborn et al. 2007), предупреждая «заиливание» — проблему, достаточно часто возникающую с песчаным грунтом.
Биотурбация в морском аквариуме
Несмотря на то, что подавляющее большинство изучавшихся биотурбационных организмов маловероятно встретить в аквариумной системе (например, пескожила, Arenicola marina, который может быть знаком европейским аквариумистам из Ваттового моря), существует определённое количество организмов, ответственных за перемешивание грунта и образование нор, которые встречаются в домашних аквариумах. Главными среди подобных организмов считаются многочисленные виды полихет, которые регулярно встречаются и ведут роющий образ жизни в аквариумах (в качестве примера – Рис. 3). Верите или нет, но эти многощетинковые черви, которых многие из нас недолюбливают, на самом деле ответственны за усиление вывода нитратов из наших систем!
Ещё одна группа организмов, ответственных за биотурбацию в домашних аквариумах, — рачки бокоплавы. На самом деле, большие норы гаммарусов достаточно часто можно увидеть со стороны стекла аквариума (возможный пример – Рис. 3); эти организмы отвечают за перемещение большого объёма воды через свои норы, поскольку они проветривают норы для насыщения их кислородом. К сожалению, практически не проводится исследований по биотурбации в домашних аквариумах, но при этом нет никаких оснований считать, что этот процесс не играет столь важной роли в аквариуме, как в естественной среде. На самом деле, вполне возможно, что один из факторов, приводящих к стабильности морского аквариума, — это становление здоровой популяции инфауны. Более того, одно из возможных объяснений «синдрома старого аквариума» — уменьшение популяции инфауны с последующим снижением скорости нитрификации и денитрификации. Разумеется, подобное объяснение на данный момент является всего лишь предположением, для доказательства или опровержения которого требуется проведение тщательных исследований.
Еще один момент, о котором я пока не упомянул – роль биоирригации в живых камнях. Несмотря на то, что жесткая природа камней не позволяет биотурбации (перемешиванию) играть какую-либо роль, организмам, обитающим в живых камнях, приходится вентилировать свои норы, чтобы насыщать их кислородом, поэтому эффект от их деятельности во многом похож на результат деятельности их родственников, обитающих в песчаном грунте. К сожалению, биоирригация в жестких структурах, в частности, в живых камнях, совершенно не изучена, поэтому открывается новое поле для исследований. Тем не менее, мы вполне можем наблюдать за своими системами, как они «взрослеют» и стабилизируются параллельно с разрастанием популяций полихет и мелких ракообразных, которые становятся заметными и на живых камнях, и на песке.
Рисунок 3: Доказательство биотурбации в домашнем аквариуме. Вверху – многощетинковый червь в своей норе; внизу – многочисленные следы нор, включая одну, достигающую бескислородного участка (бескислородный участок темнее, хотя его сложно рассмотреть на используемом автором черном песке)
Роль углерода
Представив, я надеюсь, более подробную картину азотного цикла и изучив роль песчаного грунта и его обитателей в азотном цикле, осталось поговорить об ещё одном, заключительном, аспекте: углероде.
Если и был какой-то общий тренд в течение 20 лет моего увлечения аквариумистикой, обещавший увеличение жизнестойкости наших систем, то это был переход от относительно ограниченного ввода питательных веществ к активному добавлению углерода посредством различных методов. Аргумент кажется очевидным: углерод является основной пищей для экосистемы, а большее количество пищи способствует росту. И хотя это весьма упрощённое объяснение, я попробую рассказать подробнее, напрямую связав углерод с азотным циклом двумя различными способами.
Выведение углерода и азота
Когда я впервые услышал о добавлении углерода, основополагающей научной подоплёкой этой идеи было соотношение Редфилда. В качестве обоснования говорилось, что в наших аквариумах имеется избыток азота по сравнению с углеродом, который в естественной среде обычно присутствует в соотношении C(углерод):N(азот) равном 106:16. Не будучи неверным утверждением, соотношение Редфилда указывает на химический состав планктона, поэтому использующие соотношение в качестве аргумента предполагают, что нитраты потребляются и включаются в биомассу. Несмотря на то, что такая судьба действительно ждёт часть нитратов в системе, в подавляющем большинстве случаев естественный вывод проходит преимущественно посредством денитрификации, а не накопления (ассимиляции). Однако, не стоит считать, что углерод и соотношение C:N не являются важными; скорее, объяснение не столь связано с соотношением Редфилда, а в значительно большей степени с окислительно-восстановительным каскадом.
Как я уже говорил, углерод является топливом, приводящим в действие окислительно-восстановительный каскад, который протекает в грунте и в живых камнях, одним из важнейших этапов которого является денитрификация. Это означает, что для денитрификации необходимо достаточное количество органических веществ не только для потребления кислорода, но и для использования в процессе самой денитрификации. В большинстве аквариумов обычно встречается первый вариант, а о формировании бескислородных участков можно легко судить по цвету грунта. Однако, особенно в случае очень большого избытка нитратов, углерода может быть недостаточно для протекания денитрификации и удаления всех имеющихся нитратов. В таких случаях, добавление углерода обеспечивает необходимую поддержку процесса, что должно привести к уменьшению содержания нитратов в ситуации, когда количество углерода ограничено.
Это единственный случай, когда добавление углерода непосредственно влияет на протекание азотного цикла, но я бы хотел предложить дополнительный механизм, который напрямую активизирует биотурбацию, о которой мы говорили выше, но этот механизм более сложный и больше связан с экологией аквариумной системы.
Углерод и биотурбация
Как уже описывалось выше, присутствие инфауны и ее деятельность способны оказывать существенное влияние на азотный цикл, напрямую увеличивая скорость протекания нитрификации и, особенно, денитрификации. Во многих случаях, влияние инфауны напрямую связано с разнообразием (Norling et al. 2007) и/или плотностью организмов (Waldbusser et al. 2004) настолько, что увеличение разнообразия и плотности линейно, а часто в геометрической прогрессии увеличивает скорость денитрификации. В любом случае, представители бентической фауны являются гетеротрофными организмами, поэтому увеличение количества питательных веществ, в частности, углерода, напрямую влияет на наличие пищи. Увеличение количества пищи способствует поддержанию большей популяции, соответственно, сразу же увеличивается плотность этих полезных организмов.
Помимо просто поддержания большей популяции, увеличение притока энергии в виде углерода (и азота, хотя эта тема заслуживает отдельной статьи) способствует большему разнообразию, отчасти в связи с уменьшением конкуренции (механизм ещё недостаточно известен, хотя взаимосвязь подтверждена документально). В связи с тем, что разнообразие фауны прямо пропорционально увеличивает способность грунта выводить азот посредством денитрификации, этот способ представляет собой ещё один метод использования углерода для увеличения способности системы выводить и регулировать уровень азота. И хотя совет не новый, надеюсь, он представляет собой дополнительный научный стимул к набирающему популярность тренду добавления в аквариумные системы углерода и питательных веществ.
Заключение
Несмотря на то, что большинство аквариумистов знакомы с азотным циклом практически с первого дня содержания аквариума, многие ограничиваются лишь общим представлением о процессе. Классический азотный цикл не является неправильным, но нюансы цикла и, в особенности, регулирующие его факторы, зачастую упускаются из виду в популярной аквариумной литературе. Помимо деталей самого азотного цикла я рассказал о различных факторах, влияющих на способы и скорость перемещения азота в наших системах. Я также рассказал о теориях биотурбации и биоирригации, о способах, при помощи которых разнообразные и зачастую непредсказуемые организмы, оказавшиеся в наших аквариумах, вносят свой вклад в здоровье системы. Надеюсь, эта информация поможет не только оценить по достоинству организмы, которые ранее считались паразитами, но и понять экологические аспекты, которые могут пригодиться аквариумистам. Наконец, я рассказал о важной роли углерода в свете обсуждения полной картины азотного цикла и, надеюсь, я отчасти способствовал если не активному применению добавок углерода, то, по крайней мере, отходу от старого представления о содержании рифов при минимуме питательных веществ в системе.
Источник перевода: zoologiafantastica.com