Еще совсем недавно я сделал свои первые шаги в аквариумистике , как и у каждого начинающего аквариумиста,- были у меня свои ошибки и промахи, и вообщем то и сейчас бывают.
Но благодаря обдуманным действиям, - эти ошибки не имели катострофических последствий для обитателей моего аквариума, я не остался разочарованным в этом увлечении, и мой аквариум не пошел с «молотка» как неудавшееся хобби..
Когда я еще только был в раздумьях, нужен мне аквариум или нет, на рынке мне попалась на глаза книга « Аквариум. Начинающим и не только.», автор - Шереметьв И.И., - раскрыв ее на первой случайной странице я начал читать, там было написано: « - Аквариумистика, - это удивительное хобби, благодаря которому вы не только освоите содержание рыб и растений, приобритете новые знания, но и возможно измените свою жизнь….» . , затем перелистывая книгу мое внимание привлекли полезные резюме в конце каждой главы, - и я купил ее….
Прочитав книгу , - я собрал все резюме в один список, расставил их в определенном порядке, - и увидел для себя в этом такой себе план действий, стратегию если хотите создания своего первого аквариума.
В этом резюме нет никаких конкретных цифр и точных указаний.
Читая пункт за пунктом, я дополнял, уточнял, конкретизировал информацию с помощью книг, аквариумных ресурсов из интернета и аквафорумов , и таким образом определился для себя, что же я все таки хочу видеть в своем аквариуме и что необходимо знать и сделать что бы мой аквариум упешно развивался, его обитатели чувствовали себя комфортно и чтобы аквариум радовал не только меня, но и мою семью и друзей которые часто бывают у меня в гостях .
Если подходить к увлечению обдумано и рассудительно то аквариумистика, - это прекрасное, занимательное и полезное увлечение, которое помогает смотреть на мир в живых и насыщенных красках.
Возможно, ниже следующее резюме поможет еще кому то найти свой, индивидуальный подход к такому замечательному увлечению под названием - АКВАРИУМ….
ПОЛЕЗНОЕ РЕЗЮМЕ ЧАЙНИКАМ:
- -Современные аквариумы чаще всего изготавливаются из силикатного стекла, швы которых склеены специальным силиконовым клеем.
– -Силиконовые клеи очень прочны и при соблюдении технологии склейки, нет оснований опасаться что аквариум протечет.
– -Большие аквариумы могут иметь ребра жесткости и стяжки для прочности, а могут выполнятся и без них при соблюдении расчета на прочность.
– -Аквариумы бывают различных форм и размеров в зависимости от их назначения.
– -Кроме общего аквариума в котором будут жить Ваши рыбки и растения, в хозяйстве аквариумиста необходимы и другие сосуды.
– -Изготовление домашнего водоема лучше все – таки, поручить специалисту или приобрести в специализированом магазине, поскольку у соседа этажем ниже тоже может быть евроремонт...
– -В правильно оборудованном аквариуме обязательно должен быть фильтр, обогреватель и освещение с учетом требований к условиям содержания рыб и растений, а также с учетом объема аквариума.
– -Помимо основного оборудования вам понадобится немало мелкого инвентаря.
- -Фильтрующий материал следует регулярно промывать водой комнатной температуры, без применения моющих средств, что бы не погубить полезные микроорганизмы которые значительно повышают эффективность фильтрации. Помните что живые растения являются самым эффективным биофильтром.
– -Фильтр должен работать круглосуточно и прокачивать весь объем аквариума минимум 2-4 раза в час. И не переживайте за электроэнергию, современные фильтры потребляют мизер электроэнергии.
– -При покупке обогревателя отдайте предпочтение обогревателю со встроенным терморегулятором и не забудьте установить термометр для контроля за температурой в аквариуме.
- -Проще всего возложить обязанности по включению и выключению света на таймер, - это очень удобно!
– -Освешение в аквариуме и его продолжительность наиболее важны для хорошего роста растений, а также что бы подчеркнуть окраску рыб.
-------- -Лампы должны быть правильно подобраны по мощности и спектру.
– -Аквариумный грунт недолжен выделять в воду химические вещ-ва и является очень важной составляющей экологической системы Вашего акварума.
– -Хороший грунт – окатанный гравий природных темных цветов.
– -Размер фракции (частичек) грунта и толщина слоя грунта в аквариуме зависят от того каких рыб и растения вы хотите содержать.
– -Грунт перед укладкой в аквариум тщательно промывают, но кипятить грунт не обязательно.
– -Для создания красивых декораций в аквариумистике успешно используются камни, коряги, все возможные объемные фоны и т.д.
– -Большие камни и коряги необходимо прочно устанавливать в аквариуме.
– -В аквариуме с растительноядными рыбами можно использовать живые аквариумные растения с жесткими листьями или имитации аквариумных растений.
– -Кроме рыб, растений, моллюсков и ракообразных в аквариуме обитают и другие живые организмы которые селятся там помимо нашей воли.
– -Заселенный аквариум является небольшой экологической системой которую можно и нужно сбалансировать так, чтобы она существовала если не самостоятельно, то в крайнем случае с минимальным вмешательством человека и является основной задачей аквариумиста.
– -Заселение нового аквариума не терпит спешки, все нужно делать обдуманно и не спеша.
– -Наиболее важным в домашнем водоеме является обеспечение круговорота азота.
– -Ежедневный уход за аквариумом не занимает много времени.
– -Раз в неделю аквариуму нужно уделить побольше внимания.
– -Несмотря на то что химия не является простой наукой, аквариумисту все же необходимо знать кое что о процессах происходящих в воде.
– -Подмена воды – простой и незаменимый способ удаления из аквариума вредных веществ и очень важна для установления биологического равновесия в Вашем аквариуме, но воду из аквариума никогда не выливают полностью.
– -Жесткость и величина водородного показателя – одни из важнейших свойств воды, влияющих на все живые организмы.
– -Резкие изменения величины водородного показателя (рН) очень опасны для подводных обитателей.
– -Избежать колебаний рН помогает наличие у воды буферных свойств.
– -Углекислый газ – основа питания растений и важная составляющая буферной системы Вашего домашнего водоема.
– -Кислород необходим для дыхания практически всех живых организмов и участвует в круговороте азота.
– -Аквариумные растения - самый эффективный биологический фильтр и источник кислорода в аквариуме.
– -Не стоит аквариумные растения называть водорослями, – Вы ошибаетесь..
– -Для выращивания в аквариуме существует много видов водных растений с различной окраской, формой листьев, размерами и условиями содержания.
– -Большинство аквариумных растений быстро размножаются вегетативным способом.
– -Удобрения в виде шариков, конусов, таблеток добавляемых в грунт под корни растений или жидкие удобрения растворяемые в воде, позволяют значительно улучшить внешний вид аквариумных растений, но требуют определенных знаний и опыта в их применении.
– -Содержание моллюсков обычно не обременительно и не надо перекладывать на них работу по чистке стенок аквариума от водорослей, и дна от грязи.
– -Ракообразные в пресноводном аквариуме представлены многими видами креветок, раков и крабов.
– -В аквариуме с рыбами нельзя содержать насекомых и их личинок, а также черепах, лягушек и тритонов, которые являются хищниками и нуждаются в отдельном водоеме.
– -Некоторые виды рыб поедают моллюсков, охотятся на креветок и линяющих раков.
- -Далеко не всегда для различных видов животных и растений можно создать одинаковые условия содержания , приобретая животных и растения для своего аквариума следует это учесть..
– -Подбор отдельных видов рыб и водных растений для содержания в общем аквариуме – весьма непростая задача, нужно найти компромисс между стремлением собрать как можно большую коллекцию и необходимостью создать всем ее представителям комфортные условия содержания, позволяющие проявиться внешнему виду и насыщенности окраски рыб и растений в полном их великолепии.
– -Старайтесь кормить рыб один-два раза в день, в одно и тоже время небольшими порциями, разнообразной пищей. Не перекармливайте рыб.
– -Помните что существуют специальные корма позволяющие питаться вашим обитателям в Ваше отсутствие.
– -Многие но далеко не все виды рыб могут размножаться в неволе.
– -Для размножения необходим аквариум – нерестовик в котором создаются специальные условия.
– -Проще всего получить потомство от живородящих рыб.
– -Мальки питаются специальными кормами.
– -Главное правило при выращивании молоди – чистая вода насыщенная кислородом и обильное сбалансированное питание.
– -Аквариумные рыбки иногда болеют, заболевания могут быть вызваны разными причинами, по чаще всего это результат содержания рыб в плохих условиях.
– -Болезни рыб бывают инфекционными и неинфекционными и они не представляют никакой опасности для человека.
– -Гораздо легче не допустить появления заболевания у рыб нежели лечить.
– -Прежде чем начинать лечение, необходимо установить причину болезни и выбрать соответствующие препараты.
– -Курс лечения всегда нужно довести до конца.
– -Карантин вновь прибывших рыб и растений избавит Вас от неприятных неожиданностей.
– -Не ленитесь использовать специализированную литературу, обращайтесь за помощью или советом к опытному аквариумисту, общайтесь с помощью аквафорумов с другими аквариумистами и у Вас обязательно все получится, Вы никогда не разочаруетесь, а Ваш аквариум будет завораживать своей красотой очень долго !
Удачи Вам друзья..
Живая вода
-
dankorad
- Москва
- 4248 / 2792 раза
Я тут недавно перечитала советскую книжку Слепцовой "аквариум и его обитатели" и поняла, что аквариумистика сильно шагнула вперед. Там написано буквально следующее: "Помните, что как только каркасный аквариум стал на место, следующие шаги нужно делать не откладывая, так как аквариум без воды нельзя оставлять более чем на 2 суток - замазка может потрескаться и дать течь"
Или вот: " В тропическом пресноводном аквариуме плотность посадки рыб зависит от объема сосуда и размера рыбки - на каждую рыбку от 5 см должно приходиться не меньше 2 л воды, на маленькую не меньше литра"
Или вот: " В тропическом пресноводном аквариуме плотность посадки рыб зависит от объема сосуда и размера рыбки - на каждую рыбку от 5 см должно приходиться не меньше 2 л воды, на маленькую не меньше литра"
-
Fishermen555F
- 1600 / 3241 раз
- Согласен с вами, однако всем нам важно знать что например регулярные подмены воды и обеспечение круговорота азота были необходимым условием и имели первостепенное значение как 40 лет назад, так и сейчас. :ot_riad: :-)dankora Я тут недавно перечитала советскую книжку Слепцовой "аквариум и его обитатели" и поняла, что аквариумистика сильно шагнула вперед.
-
Fishermen555F
- 1600 / 3241 раз
Кислород.
Атмосфера Земли образовалась благодаря именно кислороду и на 1/5 состоит из этого газа.
Практически для всех живых организмов кислород является основным жизненным элементом и аквариум не исключение.
Кислород не оказывает непосредственного влияния на рН или жесткость воды, однако этот элемент принимает активное участие в биохимических процессах и оказывает значительное влияние на состояние экологической системы аквариума в целом, - растениям и животным он необходим для дыхания, бактерии живущие в грунте и фильтре разлагают продукты отходов и эффективно превращают их в относительно неядовитую для рыб и доступную для питания растений субстанцию, только при достаточном количестве кислорода.
Кислород может поступать в воду двумя основными путями:
1. Посредством газообмена в результате соприкосновения поверхности воды с атмосферным воздухом и чем больше площадь поверхности воды, тем лучше вода насыщается кислородом.
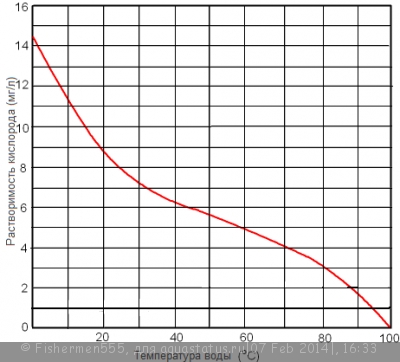
Эффективность этого процесса в значительной степени зависит от тампературы воды, так как растворимость газов в воде существенно снижается с повышением ее температуры: Следует также понимать, что ко всему выше сказанному при повышении температуры воды потребность в кислороде у рыб тоже увеличивается из-за усиления обмена веществ их организма.
По этой причине мы выбираем аквариумы оптимальные по размерам, обеспечиваем в них аэрацию, фильтрацию и как следствие способствуем насыщению воды кислородом и равномерной циркуляции/перемешивание воды по всему объему, стермимся обеспечить охлаждение аквариума в летний зной и при мощном освещении , - защищая водоем от разогрева.
2. Посредством фотосинтеза растений, которые в этом процессе потребляют углекислый газ и выделяют кислород , а скорость этого процесса зависит от от силы света падающего на листья растений.
Нижняя граница допустимой концетрации кислорода в воде составляет 3-5мг/л, а верхняя 15мг/л.
Приводимые в литературе и на многих интрернет ресурсах утверждения что технические средства способны эффективно насыщать воду кислородом так же как водные растения по меньшей мере не корректны !
Водные растения однозначно превосходят аэраторы, потому что поставляют в воду растворенный в ней кислород и кроме того , через корни многие растения способны эффективно доставлять кислород и в грунт.
Следует подчеркнуть что и растениям так же необходим кислород, - в темноте когда световая фаза фотосинтеза невозможна, - хотя и в гораздо меньших количествах чем для животных.
Когда мы наблюдаем что в течения дня при освещении аквариума происходит процесс образования на поверхности листьев растений пузырьков кислорода( так называемый пирлинг) то это говорит нам о том, что в данный момент концетрация кислорода составляет не менее 8-10 мг/л и насыщение воды кислородом близко к 100% что подсказывает нам о достаточном количестве кислорода в аквариуме.
Аэраторы же, поставляют в воду атмосферный воздух, а воздух как мы знаем - это смесь газов в которой кислорода чуть больше 20% и эффективность насыщения им в значительной степени зависит как минимум от температуры воды.
Но если условия в аквариуме не позволяют в должной мере обеспечить аквариум кислородом, то безусловно технические средства просто необходимы.
Углерод.
Углерод не только важнейший элемент питания растений, потому что является базовой основой для построения органических веществ, но и через свои соеденения влияет на значения рН и жесткость воды.
Отстоянная в стакане в течении суток и дважды дистиллированая вода, в которой после процессов дистилляции практически не осталось солей при замере активной реакции казалось бы должны получить рН около 7, то есть нейтральную активную реакцию, а на самом деле получим рН 5,5 - 6,0.
Какое же вещество успело попасть в воду ?
Все дело в том, что происходит интенсивное впитывание газов из атмосферы, и несмотря на то что в воздухе которым мы дышим содержится 78% азота, 20% кислорода и 0,03% углекислого газа, тем не менее воду они насыщают иначе.
Углекислый газ (СО2) растворяется в воде в 50 раз лучше того же кислорода и в результате образует угольную кислоту(Н2СО3), именно ее присутствие вызывает отклонение рН в кислую сторону.
Присутствие углекислоты в воде очень важно, так как ее соединения с кальцием и магнием образуют карбонаты, а сочетание углекислоты с карбонатной жесткостью (кН) обеспечивают воде необходимые буферные свойства, об этом свойстве воды более подробно вы прочтете несколько позже.
Кроме атмосферного воздуха естественными, природными источниками углекислого газа являются животные ( рыбы, молюски, ракообразные), постоянно выделяется в результате разложения микроорганизмами отмерших остатков растений, животних, несъеденого корма, экскрементов и т.д.
Растворенный в воде углекислый газ большей частью остается в виде свободного СО2 (99,3%) и лишь небольшой процент превращается в угольную кислоту (Н2СО3) которая очень не устойчива и распадается, поэтому значительная часть растворенного в воде углекислого газа и находится в свободном состоянии.
Угольная кислота - слабая кислота, тем неменее в результате диссоциации концетрация ионов Н+ повышается и вода подкисляется.
Лишь газообразный растворенный в воде СО2 подходит для питания растений без всяких осложнений, но разные виды растений обладают различной способностью покрывать свою потребность в углероде. Например элодея канадская или эхинодорус при недостатке свободного СО2 способен извлекать углерод из гидрокарбонатов воды, которая как мы знаем составляют ее временную или что тоже верно - карбонатную жесткость (КН), в результате чего происходит уменьшение ее значения - это явление называется - биогенное умягчение воды.
Но, например мох ключевой в отличии от элодеи или эхинодоруса способен питаться исключительно свободным СО2, и при его недостатке деградирует и гибнет.
Между этими видами условно можно распределить остальные виды растений, из чего видно что вокруг углерода в аквариуме разгорается конкуренция, поэтому растения переносящие высокие значения рН имеют приимущества перед растениями не обладающими такими способностями.
Поэтому для достаточного снабжения всех растений углекислым газом, к аквариумам с разнобразной , густой растительностью и достаточно сильным освещением как правило подключают дополнительную подачу СО2.
Недостаток СО2 в воде в основном является причиной:
- появления искалеченых и убогих растений в аквариуме;
- недопустимых сильного повышения рН или его значительных суточных колебаний
В свою очередь слишком высокое значение рН вызванное недостатком СО2 как правило является причиной:
- недостатка железа и некоторых других элементов для питания растений, так как при высоком рН они в значительной степени переходят в состояния в которых растениям их не хватает или не способны усваивать несмотря на систематическое внесение удобрений : - аммиачного отравления рыб , особенно после смены воды, так как от активной реакции зависит и доля образующегося в результате аммиака: - наступления криптокориновой болезни;
- прекращения роста и деградации растений;
- тяжелых хронических заболеваний рыб.
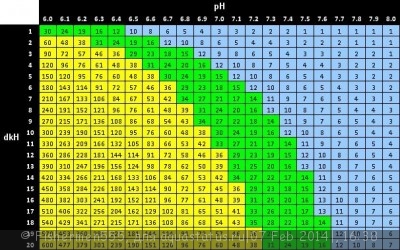
Определить концетрацию СО2 в воде можно с достаточной точностью зная значения рН и кН, с помощью таблицы которую составил К.Хорст:
Применяются также капельные тесты и все возможных конструкций самодельное или заводского изготовления устройство - так называемый дропчекер: В такое устройство заливается реагент который в зависимости от концетрации СО2 изменяет свой цвет и сверив с прилагаемой шкалой можно приблизительно определить количество СО2 в воде.
рН - водородный показатель
Водородный показатель обозначают латинскими буквами рН и означают pondus hydrogenii - "водородный показатель" - это очень важная составляющая характеристики воды.
рН характеризует ее активную реакцию - нейтральную, кислую или щелочную. Всем известно что молекула воды состоит из двух атомов водорода и одного атома кислорода - Н2О .
Однако не все помнят что молекулы в растворе ( вода в аквариуме это ни что иное как раствор ),находятся не в целостном состоянии, а в виде ионов - положительно и отрицательно заряженых частиц.
Это явление называется диссоциацией, и следует понимать, что в химически чистой воде лишь 1/10000000 часть общего числа микрочастиц диссоциирована на ионы Н+ и ОН- , а следовательно может вступать в реакции.
Так вот степень диссоциированности молекул воды и называют активной реакцией и измеряют величиной водородного показателя рН,
равного степени концетрации ионов Н+, взятой с обратным знаком.
Для химически чистой воды это показтель (рН) равен 7, но стоит добавить в такую воду какое либо вещество - и доля диссоциированых молекул, а значит и величина рН начнет изменятся.
Например если мы добавляемм кислоту, то кол-во свободных ионов Н+ возрастает ( молекулы кислоты диссоциируя, насыщают ими воду), а следовательно, увеличивается их доля в объеме - рН при этом уменьшается, и тем больше, чем больше мы насыщаем воду кислотой.
И наоборот, если мы добавляем в воду щелочь , то доля диссоциированных ионов Н+ сокращается , а водородный показатель рН растет.
Поэтому воду называют при рН:
1-3 - сильнокислой
3-5 - кислой
5-7 слабокислой
7 - нейтральной
7-9 - слабощелочной
9-11 - щелочной
11-14 сильнощелочной.
Таким образом резкое, незначительное казалось бы отклонение показателя рН на единицу, на самом деле означает изменение концетрации в 10 раз ! ( так как в основе лежит десятичный антилогарифм) и для живого существа бесследно не проходит. Причина этого опять таки кроется в биохимических процессах : организм живет пока клетка способна поддерживать рН своей плазмы в определенных пределах.
Вода в большинстве пресных природных водоемах имеет рН 5-8, очень редко встречаются болотные воды с рН4.5 и щелочные озера с рН9-11 - в таких экстремальных условиях животные и высшие растения не живут, здесь встречаются лишь водоросли и различные микроорганизмы.
Значения рН в аквариуме подвержены колебаниям в следствии изменения количества растворенной в воде углекислекислоты и величины кН - карбонатной жесткости воды.
Так увеличение количества СО2 или снижение временной жесткости делает воду более кислой, а увиличение кН и уменьшение СО2 - щелочной.
Например при длительном, ярком освещении аквариума с большим количеством растений, которые при этом способны очень интенсивно поглощать углекислоту из воды - значение рН запросто может подняться даже до 9 !, а ночью в связи с увеличением концетрации углекислоты при взаимодействии воды с атмосферой, из-за дыхания рыб и растений, жизнедеятельности микроорганизмов, при слабых буферных свойствах воды - запросто может упасть до 6 !
Такие суточные колебания недопустимы в аквариуме.
На основании этого, стоит наверное упомянуть и о таком понятии как буферность воды.
Буферность - это способность раствора ( напомню что аквариумная вода - это есть слабый раствор) сохранять величину водородного показателя при добавлении щелочи или кислоты. Буферностью ничего не измеряют ее лишь характеризуют словами "слабая" или "сильная".
Буферность воды предопределяет значение карбонатной жесткости кН, чем выше кН тем сильнее буферные свойства воды и на оборот.
Например вода со слабыми буферными свойствами при добавлении в нее каждой капли кислоты или щелочи резко изменяет рН, а
вода с сильными буферными свойствами способна поддерживать величину рН постоянной, несмотря на существенные добавки кислоты или щелочи.
Разумеется что и вода с сильными буферными свойствами рано или поздно начнет изменять рН если в нее добавлять слишком много кислоты или щелочи, но важно ориентироваться в особенностях этого свойства и правильно использовать его там, где это необходимо. Жесткость воды.
Вода - универсальный растворитель и наиболее распространенное на нашей планете вещество.
Пресной водой мы называем такую воду в 1л. которой растворено не более 1г. солей, но даже такая казалось бы незначительная их концетрация оказывает существенное влияние на живущие в ней организмы.
Жесткость является одним из важнейших параметров воды в пресноводном аквариуме, от которого зависит возможность содержания и разведения рыб и культивирования растений в аквариуме.
Нужно отметить что ее значения для аквариумных рыб и растений могут значительно отличаться от значений в природных водоемах, потому что большинство рыб и растений обладают громадной приспособляемостью к условиям окружающей среды, особенно в процессе смены поколений. Итак, что же такое жесткость воды для меня как для аквариумиста ?
В общем случае, жесткость - это совокупность свойств воды, обусловленных наличием в ней солей кальция и магния.
Конечно, возможно кто то скажет что кроме Са и Mg жесткость формируют и другие ионы растворенных в воде щелочноземельных металлов таких как бериллий,стронций и барий.
Но !
Первое - в нашем с вами случае количество последних в воде ничтожно мало, поэтому ими в пресноводной аквариумистике можно смело пренебречь.
Второе и пожалуй самое главное что именно кальций и магний являются одними из наиболее активных регуляторов химических процессов в природе.
Для измерения жесткости применяют специальные единицы и в разных странах они не одинаковы.
В аквариумной практике чаще всего используют немецкие градусы жесткости.
Одному такому градусу соответствует содержание в 1л воды 10 мг окиси кальция СаО или 7,19 мг окиси магния МgО или совокупность кальциевых и магниевых составляющих в различных соотношениях.
Принято считать что при GH :
0-4 - вода очень мягкая
4-8 - вода мягкая
8-12 - вода средней жесткости
12-21 - вода жесткая
свыше 21 - вода очень жесткая. Различают общую жесткость dGH(GH) и ее составляющие - карбонатную dKH(KH) и постоянную жесткость dPH,
то есть: dGH = dKH + dPH.
dKH - карбонатная, временная или устранимая жесткость - образуется солями, возникающими от соединения Са и Mg с угольной кислотой(Н2СО3), а именно гидрокарбонатов кальция - Са(НСО3)2 и магния - Mg (НСО3)2.
Это довольно нестойкие соединения и стоит вскипятить воду и они начнут разрушаться с выделением углекислого газа и карбонатов, растворимость которых хуже.
Именно карбонаты кальция и магния остаются в виде накипи в наших чайниках или на тэнах стиральных машин.
На этой особенности основан старый и самый простой способ умягчения воды - кипячение с последующим отстаиванием и часто позволяет снизить жесткость водопроводной воды до 1/3. Карбонатная жесткость, как правило, меньше чем общая.
Но следует отметить что часто возникает парадоксальная ситуация, когда карбонатная жесткость - KН больше чем общая - GH !
Дело в том что наряду со щелочноземельными карбонатами существуют такие карбонатные соединения , как например карбонат калия или карбонат натрия.
Эти соли учитываются при при замерах карбонатной жесткости, но не учитываются в общей жесткости.
Если такая ситуация возникла то это говорит о том, что соединения такого рода содержатся в вашей воде в большом количестве.
dPH - постоянная, неустранимая или не карбонатная жесткость.
Эта составляющая общей жесткости также связана с ионами щелочноземельных металлов, но ее обуславливают другие вещества, такие как хлориды, сульфаты, нитраты, силикаты и фосфаты и ее значение в отличии от временной жесткости понизить банальным кипячением невозможно, поэтому для снижения этой составляющей применяют такие методы как разбавление дистиллированой или хотя бы более мягкой водой, дистилляция, вымораживание, электролиз, обратный осмос, ионообменные смолы.
Экологическое равновесие и круговорот азота.
Экологическая система.
Аквариум - это экологическая система, - сообщество животных и растений существующих в определенных условиях неживой природы. Аквариум как и другие экосистемы, включает в себя несколько групп организмов, между которыми происходит неперывный процесс обмена веществ. Происходит циркуляция последнего в нутри единого природного комплекса, в нашем с вами случае - это аквариум, что и обеспечивает его существование.
Все подобные сообщества обладают определенным сходством.
Они самодостаточны и могут существовать неограниченно долгое время,если условия остаются постоянными либо, по крайней мера изменяются предсказуемо.
Именно эта особенность должна интересовать нас в первую очередь и суть ее заключается в том , что можно обеспечить такое взаимодействие организмов, при котором водоем существует самостоятельно и мы вмешиваемся в процессы, протекающие в нем, лишь в случае крайней необходимости.
В каждой экосистеме можно выделить следующие составляющие:
1. Производители.
Это в основном, растения использующие в качестве строительного материала для своих листьев вещества содержащиеся в атмосфере и воде. Производителей в экологии называют продуцентами.
2. Потребители.
Потребителей в экологии называют консументами, которые бывают двух основных типов: одни поедают растения, другие животные организмы.
3. Разрушители вещества ( или другими словами - энергии запасенной в веществе).
Разрушителей в экологии называют редуцентами и сапрофитами . Это как правило простейшие грибы и микроорганизмы, которые разрушают органическое вещество до минеральных составляющих, пригодных для использования растениями.
Несмотря на круговорот веществ внутри экосистемы, часть энергии все же поступает извне, а часть теряется ею.
Возьмем к примеру нашу землю в целом: все мы существуем за счет потока солнечной энергии, а часть газов и водяного пара непрерывно рассеивается в космос.
Участок реки также является экосистемой: вода постоянно поступает из верхнего течения и тут же устремляется дальше, к низовью.
В случае с аквариумом часть энергии поступает от нас при кормлении рыб, а вещества оставшиеся невостребованными обитателями аквариума мы убираем во время чистки и подмены воды в аквариуме. Экологическое равновесие.
Чтобы вода в аквариуме всегда была кристально чистой, растения пышными и сочными, а рыбы здоровыми, составляющие крошечной экосистемы за стекляными берегами должны быть сбаллансированы. Нам уже известно, что в аквариуме рыбы дышат кислородом и поедают различный корм, выделяют в воду углекислый газ, мочевину и экскременты.
Микроорганизмы разлагают выделения, отмершие части растений и т.д. превращая все это в минеральные вещества, которые в свою очередь усваивает флора.
Растения в свою очередь, кроме того что нуждается в углекислом газе в дневной фазе фотосинтеза, нуждаются и в кислороде - в ночное время, пусть даже и в значительно меньшем количестве чем рыбы.
На свету в клетках растений образуются сахара для их же питания и роста, и насыщают воду кислородом, который необходим живым организмам.
Кое-что из аквариума следует периодически, своевременно удалять - эту заботу мы берем на себя.
В правильно сбаллансированом аквариуме , достаточно лишь периодически подменить часть воды.
Остановимся подробнее на самых полезных , но менее всего понятных нам сапрофитах - микроорганизмах превращающих продукты жизнедеятельности организмов в питательные вещества для растений, таким образом поддерживая экологическое равновесие в акариуме и являются очень важной составляющей экосистемы.
Многие начинающие недооценивают вклад невидимых помошников.
Вместо того что бы постараться сбаллансировать все компоненты миниатюрного искуственного природного комплекса, они с первых дней пытаются навести в аквариуме никому не нужную идеальную чистоту, - льют в аквариум дезинфицирующие вещества, в место частичной подмены полностью выливают воду из него воду,промывают и даже кипятят грунт, отключат на ночь фильтр что бы не шумел и прочее.
Однако результат получают обратный желаемому: вода все равно мутнеет, растения погибают, а рыбы болеют. И все потому , что своими неумелыми и необдуманными действиями они уничтожают своих неоцинимых невидимых помошников - полезные микроорганизмы - грибы, инфузории и бактерии, питающиеся мертвым органическим веществом.
Они не претендуют на поедание живых клеток, поскольку этим занимаются действительно вредные микроорганизмы, вызывающие болезни.
Полезные микроорганизмы попадают в домашний водоем из атмосферы которая нас окружает, с растениями на листьях и корнях которых присутствует какое -то количество полезных микробов.
Оказавшись в подходящих условиях, полезные микроорганизмы начинают размножаться, пока их количество не достигнет определенного уровня, четко согласованного с числом рыб и растений в замкнутом пространстве аквариума. Поэтому неудивительно что больше всего их будет там где больше всего скапливается "грязь" - в грунте среди писчинок и в фильтрах.
Обычно, в только что правильно оборудованном аквариуме идеально чистой вода бывает только первый день-два, затем становится несколько сизой.
Полезных бактерий в это время явно не хватает, однако они способны быстро размножаться и уже максимум через неделю вода вновь становится кристально чистой.
С этого момента устанавливается определенный балланс и можно высаживать растения и добавлять по немногу рыб, - по немногу для того, что бы между микроорганизмами и количеством появляющихся в результате кормления рыб органических остатков которыми питаются бактерии успевал устанавливаться балланс. Мы можем способствовать процессу установления экологического равновесия: самый простой способ, применяемый аквариумистами уже не одно десятилетие - это добавить в новый аквариум небольшого количиства воды из уже устоявшегося и благополучного аквариума, врезультате чего ускоряется процесс заселения грунта и фильтра полезными микроорганизмами.
В наши дни без каких либо сложностей можно приобрести специальные препараты разных производителей - биостартеры, содержащие "рассаду" полезных микробов для вновь оборудуемых аквариумов, например: JBL Denitrol , TetraAqua Bactozym, Dennerle FB1. SubstrateStart, AQUAYER Биостартер и др.
Азотный цикл
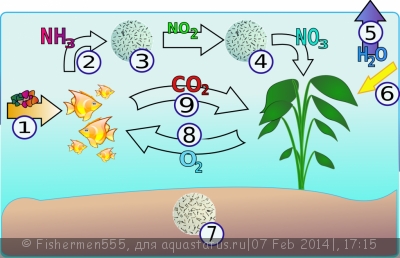
Азот входящий в состав белков,конечно же , играет огромную роль в круговороте веществ любой экологической системы и аквариум как мы понимает тоже не исключение, это особенно важно поскольку не все соединения азота полезны для живых организмов.
Белки - органические вещества,являющиеся основой всего живого, содержат не мало азотных соединений.
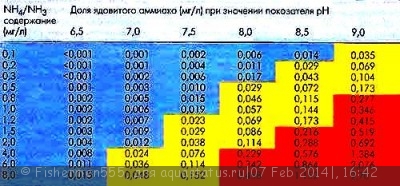
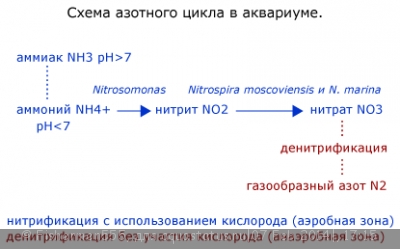
Мы знаем что отмершие части растений, несъденый корм , экскременты рыб и пр. разлагаются сапрофитами, и азот из белков переходит в состав мене сложных химических соединений, приимущественно в аммоний (NH4), в малых концетрациях не приносящий вреда рыбам и растениям.
Сдержащие азот аммоний и нитрат являются важными питательными веществами для водных растений, которые они извлекают из воды.
Под воздействием бактерий он превращается в нитриты (NO2), которые снова таки под воздействием бактерий преобразуются в нитраты (NO3).
Бактерии (Bacterium coli, Bacterium proteus,Bacterium subtilis), которые обеспечивают превращения азота в нитраты и называются нитрифицирующими бактериями.
Таким образом происходит круговорот азота.
Несмотря на то, что в благополучном аквариуме азотный цикл осуществляется полностью, соотношения соединений при этом совершенно не такие как в большинстве природных водоемов.
Так как в аквариуме больше тех кто потребляет и меньше тех кто производит, при этом полезных бактерий в аквариуме значительно меньше чем в природе.
Из-за не правильного соотношения производителей и потребителей в воде в избытке могут накапливаться соеденения азота что приводит к вспышкам водорослей, угнетает рыбу и малька, замедляется фотосинтез у растений даже если освещение достаточно яркое.
В связи с этим старая вода в аквариуме не мене опасна, чем слишком свежая и поэтому для того что бы создать успешный и красивый аквариум , аквариумист обязательно должен соблюдать правила ухода за аквариумом с учетом индивидуальных особенностей конкретного домашнего водоема.
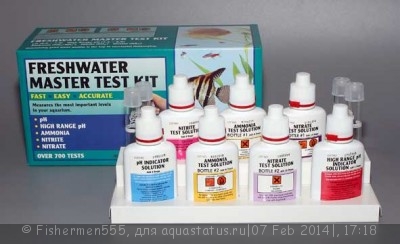
Для контроля концетраций азотных веществ в современной аквариумистике при необходимости применяются специальные тесты на нитрат, нитрит, аммиак/аммоний, фосфат разнообразных производителей. Как правило, в зависимости от типа аквариума допускаются следующие концетрации соединений азота в аквариуме:
1. NO3/нитрат - нормальная концетрация 0-25 мг/л, превышение 25-100 мг/л - у нежных рыб возможны отравления, свыше 100 неизбежны отравления и даже летальный исход.
2. NO2/нитрит - нормальная концетрация 0 мг/л , превышение (0.2-5) возможны отравления, свыше 5 неизбежны отравления и даже летальный исход.
3. NH4/аммоний - нормальная концетрация 0 мг/л, превышение (0.02-0.05) возможны отравления, свыше 0.05 неизбежны отравления и даже летальный исход . Это при плавном повышении. При резком скачке (например при неправильной пересадке рыбы или массированной подмене на чистую воду) последствия могут наступить и при меньших значениях!
4. РО4/фосфат - нормальная концетрация 0 - 2.0мг/л. Более высокие концетрации не столько опасны для рыб, сколько являются причиной появления водорослей. Материал взят из :
"Аквариум" Шереметьев И.И. 2002
"Современное аквариумное оборудование" В.Д. Полонский. 2006
"Настольная книга аквариумистов" Кочетов А. 1997
"Подготовка воды и изменение гидрохимических показателей" Хомченко И. 1991
"Вода как среда обитания и практика аквариумной гидрохимии" Махлин М.Д. 1988
"Содержание рыб в замкнутых системах" Спотт С. 1983
Основные параметры воды в аквариуме - какие они должны быть?
Фото аквариумов и аквариумных рыб
P.S. Вот вообщем и все, что я хотел рассказать новичкам, прежде чем они возьмутся за создание аквариума.
Сарперцев прошу тапками не кидать, несуществует ни одной книги в которой можно было бы быть согласным с каждым словом. .
Для тех, кто думает что так просто сесть и тупо переписать, скажу одно: попробуйте !
Возможно у вас получится лучше. :uch_tiv:
Атмосфера Земли образовалась благодаря именно кислороду и на 1/5 состоит из этого газа.
Практически для всех живых организмов кислород является основным жизненным элементом и аквариум не исключение.
Кислород не оказывает непосредственного влияния на рН или жесткость воды, однако этот элемент принимает активное участие в биохимических процессах и оказывает значительное влияние на состояние экологической системы аквариума в целом, - растениям и животным он необходим для дыхания, бактерии живущие в грунте и фильтре разлагают продукты отходов и эффективно превращают их в относительно неядовитую для рыб и доступную для питания растений субстанцию, только при достаточном количестве кислорода.
Кислород может поступать в воду двумя основными путями:
1. Посредством газообмена в результате соприкосновения поверхности воды с атмосферным воздухом и чем больше площадь поверхности воды, тем лучше вода насыщается кислородом.
Эффективность этого процесса в значительной степени зависит от тампературы воды, так как растворимость газов в воде существенно снижается с повышением ее температуры: Следует также понимать, что ко всему выше сказанному при повышении температуры воды потребность в кислороде у рыб тоже увеличивается из-за усиления обмена веществ их организма.
По этой причине мы выбираем аквариумы оптимальные по размерам, обеспечиваем в них аэрацию, фильтрацию и как следствие способствуем насыщению воды кислородом и равномерной циркуляции/перемешивание воды по всему объему, стермимся обеспечить охлаждение аквариума в летний зной и при мощном освещении , - защищая водоем от разогрева.
2. Посредством фотосинтеза растений, которые в этом процессе потребляют углекислый газ и выделяют кислород , а скорость этого процесса зависит от от силы света падающего на листья растений.
Нижняя граница допустимой концетрации кислорода в воде составляет 3-5мг/л, а верхняя 15мг/л.
Приводимые в литературе и на многих интрернет ресурсах утверждения что технические средства способны эффективно насыщать воду кислородом так же как водные растения по меньшей мере не корректны !
Водные растения однозначно превосходят аэраторы, потому что поставляют в воду растворенный в ней кислород и кроме того , через корни многие растения способны эффективно доставлять кислород и в грунт.
Следует подчеркнуть что и растениям так же необходим кислород, - в темноте когда световая фаза фотосинтеза невозможна, - хотя и в гораздо меньших количествах чем для животных.
Когда мы наблюдаем что в течения дня при освещении аквариума происходит процесс образования на поверхности листьев растений пузырьков кислорода( так называемый пирлинг) то это говорит нам о том, что в данный момент концетрация кислорода составляет не менее 8-10 мг/л и насыщение воды кислородом близко к 100% что подсказывает нам о достаточном количестве кислорода в аквариуме.
Аэраторы же, поставляют в воду атмосферный воздух, а воздух как мы знаем - это смесь газов в которой кислорода чуть больше 20% и эффективность насыщения им в значительной степени зависит как минимум от температуры воды.
Но если условия в аквариуме не позволяют в должной мере обеспечить аквариум кислородом, то безусловно технические средства просто необходимы.
Углерод.
Углерод не только важнейший элемент питания растений, потому что является базовой основой для построения органических веществ, но и через свои соеденения влияет на значения рН и жесткость воды.
Отстоянная в стакане в течении суток и дважды дистиллированая вода, в которой после процессов дистилляции практически не осталось солей при замере активной реакции казалось бы должны получить рН около 7, то есть нейтральную активную реакцию, а на самом деле получим рН 5,5 - 6,0.
Какое же вещество успело попасть в воду ?
Все дело в том, что происходит интенсивное впитывание газов из атмосферы, и несмотря на то что в воздухе которым мы дышим содержится 78% азота, 20% кислорода и 0,03% углекислого газа, тем не менее воду они насыщают иначе.
Углекислый газ (СО2) растворяется в воде в 50 раз лучше того же кислорода и в результате образует угольную кислоту(Н2СО3), именно ее присутствие вызывает отклонение рН в кислую сторону.
Присутствие углекислоты в воде очень важно, так как ее соединения с кальцием и магнием образуют карбонаты, а сочетание углекислоты с карбонатной жесткостью (кН) обеспечивают воде необходимые буферные свойства, об этом свойстве воды более подробно вы прочтете несколько позже.
Кроме атмосферного воздуха естественными, природными источниками углекислого газа являются животные ( рыбы, молюски, ракообразные), постоянно выделяется в результате разложения микроорганизмами отмерших остатков растений, животних, несъеденого корма, экскрементов и т.д.
Растворенный в воде углекислый газ большей частью остается в виде свободного СО2 (99,3%) и лишь небольшой процент превращается в угольную кислоту (Н2СО3) которая очень не устойчива и распадается, поэтому значительная часть растворенного в воде углекислого газа и находится в свободном состоянии.
Угольная кислота - слабая кислота, тем неменее в результате диссоциации концетрация ионов Н+ повышается и вода подкисляется.
Лишь газообразный растворенный в воде СО2 подходит для питания растений без всяких осложнений, но разные виды растений обладают различной способностью покрывать свою потребность в углероде. Например элодея канадская или эхинодорус при недостатке свободного СО2 способен извлекать углерод из гидрокарбонатов воды, которая как мы знаем составляют ее временную или что тоже верно - карбонатную жесткость (КН), в результате чего происходит уменьшение ее значения - это явление называется - биогенное умягчение воды.
Но, например мох ключевой в отличии от элодеи или эхинодоруса способен питаться исключительно свободным СО2, и при его недостатке деградирует и гибнет.
Между этими видами условно можно распределить остальные виды растений, из чего видно что вокруг углерода в аквариуме разгорается конкуренция, поэтому растения переносящие высокие значения рН имеют приимущества перед растениями не обладающими такими способностями.
Поэтому для достаточного снабжения всех растений углекислым газом, к аквариумам с разнобразной , густой растительностью и достаточно сильным освещением как правило подключают дополнительную подачу СО2.
Недостаток СО2 в воде в основном является причиной:
- появления искалеченых и убогих растений в аквариуме;
- недопустимых сильного повышения рН или его значительных суточных колебаний
В свою очередь слишком высокое значение рН вызванное недостатком СО2 как правило является причиной:
- недостатка железа и некоторых других элементов для питания растений, так как при высоком рН они в значительной степени переходят в состояния в которых растениям их не хватает или не способны усваивать несмотря на систематическое внесение удобрений : - аммиачного отравления рыб , особенно после смены воды, так как от активной реакции зависит и доля образующегося в результате аммиака: - наступления криптокориновой болезни;
- прекращения роста и деградации растений;
- тяжелых хронических заболеваний рыб.
Определить концетрацию СО2 в воде можно с достаточной точностью зная значения рН и кН, с помощью таблицы которую составил К.Хорст:
Применяются также капельные тесты и все возможных конструкций самодельное или заводского изготовления устройство - так называемый дропчекер: В такое устройство заливается реагент который в зависимости от концетрации СО2 изменяет свой цвет и сверив с прилагаемой шкалой можно приблизительно определить количество СО2 в воде.
рН - водородный показатель
Водородный показатель обозначают латинскими буквами рН и означают pondus hydrogenii - "водородный показатель" - это очень важная составляющая характеристики воды.
рН характеризует ее активную реакцию - нейтральную, кислую или щелочную. Всем известно что молекула воды состоит из двух атомов водорода и одного атома кислорода - Н2О .
Однако не все помнят что молекулы в растворе ( вода в аквариуме это ни что иное как раствор ),находятся не в целостном состоянии, а в виде ионов - положительно и отрицательно заряженых частиц.
Это явление называется диссоциацией, и следует понимать, что в химически чистой воде лишь 1/10000000 часть общего числа микрочастиц диссоциирована на ионы Н+ и ОН- , а следовательно может вступать в реакции.
Так вот степень диссоциированности молекул воды и называют активной реакцией и измеряют величиной водородного показателя рН,
равного степени концетрации ионов Н+, взятой с обратным знаком.
Для химически чистой воды это показтель (рН) равен 7, но стоит добавить в такую воду какое либо вещество - и доля диссоциированых молекул, а значит и величина рН начнет изменятся.
Например если мы добавляемм кислоту, то кол-во свободных ионов Н+ возрастает ( молекулы кислоты диссоциируя, насыщают ими воду), а следовательно, увеличивается их доля в объеме - рН при этом уменьшается, и тем больше, чем больше мы насыщаем воду кислотой.
И наоборот, если мы добавляем в воду щелочь , то доля диссоциированных ионов Н+ сокращается , а водородный показатель рН растет.
Поэтому воду называют при рН:
1-3 - сильнокислой
3-5 - кислой
5-7 слабокислой
7 - нейтральной
7-9 - слабощелочной
9-11 - щелочной
11-14 сильнощелочной.
Таким образом резкое, незначительное казалось бы отклонение показателя рН на единицу, на самом деле означает изменение концетрации в 10 раз ! ( так как в основе лежит десятичный антилогарифм) и для живого существа бесследно не проходит. Причина этого опять таки кроется в биохимических процессах : организм живет пока клетка способна поддерживать рН своей плазмы в определенных пределах.
Вода в большинстве пресных природных водоемах имеет рН 5-8, очень редко встречаются болотные воды с рН4.5 и щелочные озера с рН9-11 - в таких экстремальных условиях животные и высшие растения не живут, здесь встречаются лишь водоросли и различные микроорганизмы.
Значения рН в аквариуме подвержены колебаниям в следствии изменения количества растворенной в воде углекислекислоты и величины кН - карбонатной жесткости воды.
Так увеличение количества СО2 или снижение временной жесткости делает воду более кислой, а увиличение кН и уменьшение СО2 - щелочной.
Например при длительном, ярком освещении аквариума с большим количеством растений, которые при этом способны очень интенсивно поглощать углекислоту из воды - значение рН запросто может подняться даже до 9 !, а ночью в связи с увеличением концетрации углекислоты при взаимодействии воды с атмосферой, из-за дыхания рыб и растений, жизнедеятельности микроорганизмов, при слабых буферных свойствах воды - запросто может упасть до 6 !
Такие суточные колебания недопустимы в аквариуме.
На основании этого, стоит наверное упомянуть и о таком понятии как буферность воды.
Буферность - это способность раствора ( напомню что аквариумная вода - это есть слабый раствор) сохранять величину водородного показателя при добавлении щелочи или кислоты. Буферностью ничего не измеряют ее лишь характеризуют словами "слабая" или "сильная".
Буферность воды предопределяет значение карбонатной жесткости кН, чем выше кН тем сильнее буферные свойства воды и на оборот.
Например вода со слабыми буферными свойствами при добавлении в нее каждой капли кислоты или щелочи резко изменяет рН, а
вода с сильными буферными свойствами способна поддерживать величину рН постоянной, несмотря на существенные добавки кислоты или щелочи.
Разумеется что и вода с сильными буферными свойствами рано или поздно начнет изменять рН если в нее добавлять слишком много кислоты или щелочи, но важно ориентироваться в особенностях этого свойства и правильно использовать его там, где это необходимо. Жесткость воды.
Вода - универсальный растворитель и наиболее распространенное на нашей планете вещество.
Пресной водой мы называем такую воду в 1л. которой растворено не более 1г. солей, но даже такая казалось бы незначительная их концетрация оказывает существенное влияние на живущие в ней организмы.
Жесткость является одним из важнейших параметров воды в пресноводном аквариуме, от которого зависит возможность содержания и разведения рыб и культивирования растений в аквариуме.
Нужно отметить что ее значения для аквариумных рыб и растений могут значительно отличаться от значений в природных водоемах, потому что большинство рыб и растений обладают громадной приспособляемостью к условиям окружающей среды, особенно в процессе смены поколений. Итак, что же такое жесткость воды для меня как для аквариумиста ?
В общем случае, жесткость - это совокупность свойств воды, обусловленных наличием в ней солей кальция и магния.
Конечно, возможно кто то скажет что кроме Са и Mg жесткость формируют и другие ионы растворенных в воде щелочноземельных металлов таких как бериллий,стронций и барий.
Но !
Первое - в нашем с вами случае количество последних в воде ничтожно мало, поэтому ими в пресноводной аквариумистике можно смело пренебречь.
Второе и пожалуй самое главное что именно кальций и магний являются одними из наиболее активных регуляторов химических процессов в природе.
Для измерения жесткости применяют специальные единицы и в разных странах они не одинаковы.
В аквариумной практике чаще всего используют немецкие градусы жесткости.
Одному такому градусу соответствует содержание в 1л воды 10 мг окиси кальция СаО или 7,19 мг окиси магния МgО или совокупность кальциевых и магниевых составляющих в различных соотношениях.
Принято считать что при GH :
0-4 - вода очень мягкая
4-8 - вода мягкая
8-12 - вода средней жесткости
12-21 - вода жесткая
свыше 21 - вода очень жесткая. Различают общую жесткость dGH(GH) и ее составляющие - карбонатную dKH(KH) и постоянную жесткость dPH,
то есть: dGH = dKH + dPH.
dKH - карбонатная, временная или устранимая жесткость - образуется солями, возникающими от соединения Са и Mg с угольной кислотой(Н2СО3), а именно гидрокарбонатов кальция - Са(НСО3)2 и магния - Mg (НСО3)2.
Это довольно нестойкие соединения и стоит вскипятить воду и они начнут разрушаться с выделением углекислого газа и карбонатов, растворимость которых хуже.
Именно карбонаты кальция и магния остаются в виде накипи в наших чайниках или на тэнах стиральных машин.
На этой особенности основан старый и самый простой способ умягчения воды - кипячение с последующим отстаиванием и часто позволяет снизить жесткость водопроводной воды до 1/3. Карбонатная жесткость, как правило, меньше чем общая.
Но следует отметить что часто возникает парадоксальная ситуация, когда карбонатная жесткость - KН больше чем общая - GH !
Дело в том что наряду со щелочноземельными карбонатами существуют такие карбонатные соединения , как например карбонат калия или карбонат натрия.
Эти соли учитываются при при замерах карбонатной жесткости, но не учитываются в общей жесткости.
Если такая ситуация возникла то это говорит о том, что соединения такого рода содержатся в вашей воде в большом количестве.
dPH - постоянная, неустранимая или не карбонатная жесткость.
Эта составляющая общей жесткости также связана с ионами щелочноземельных металлов, но ее обуславливают другие вещества, такие как хлориды, сульфаты, нитраты, силикаты и фосфаты и ее значение в отличии от временной жесткости понизить банальным кипячением невозможно, поэтому для снижения этой составляющей применяют такие методы как разбавление дистиллированой или хотя бы более мягкой водой, дистилляция, вымораживание, электролиз, обратный осмос, ионообменные смолы.
Экологическое равновесие и круговорот азота.
Экологическая система.
Аквариум - это экологическая система, - сообщество животных и растений существующих в определенных условиях неживой природы. Аквариум как и другие экосистемы, включает в себя несколько групп организмов, между которыми происходит неперывный процесс обмена веществ. Происходит циркуляция последнего в нутри единого природного комплекса, в нашем с вами случае - это аквариум, что и обеспечивает его существование.
Все подобные сообщества обладают определенным сходством.
Они самодостаточны и могут существовать неограниченно долгое время,если условия остаются постоянными либо, по крайней мера изменяются предсказуемо.
Именно эта особенность должна интересовать нас в первую очередь и суть ее заключается в том , что можно обеспечить такое взаимодействие организмов, при котором водоем существует самостоятельно и мы вмешиваемся в процессы, протекающие в нем, лишь в случае крайней необходимости.
В каждой экосистеме можно выделить следующие составляющие:
1. Производители.
Это в основном, растения использующие в качестве строительного материала для своих листьев вещества содержащиеся в атмосфере и воде. Производителей в экологии называют продуцентами.
2. Потребители.
Потребителей в экологии называют консументами, которые бывают двух основных типов: одни поедают растения, другие животные организмы.
3. Разрушители вещества ( или другими словами - энергии запасенной в веществе).
Разрушителей в экологии называют редуцентами и сапрофитами . Это как правило простейшие грибы и микроорганизмы, которые разрушают органическое вещество до минеральных составляющих, пригодных для использования растениями.
Несмотря на круговорот веществ внутри экосистемы, часть энергии все же поступает извне, а часть теряется ею.
Возьмем к примеру нашу землю в целом: все мы существуем за счет потока солнечной энергии, а часть газов и водяного пара непрерывно рассеивается в космос.
Участок реки также является экосистемой: вода постоянно поступает из верхнего течения и тут же устремляется дальше, к низовью.
В случае с аквариумом часть энергии поступает от нас при кормлении рыб, а вещества оставшиеся невостребованными обитателями аквариума мы убираем во время чистки и подмены воды в аквариуме. Экологическое равновесие.
Чтобы вода в аквариуме всегда была кристально чистой, растения пышными и сочными, а рыбы здоровыми, составляющие крошечной экосистемы за стекляными берегами должны быть сбаллансированы. Нам уже известно, что в аквариуме рыбы дышат кислородом и поедают различный корм, выделяют в воду углекислый газ, мочевину и экскременты.
Микроорганизмы разлагают выделения, отмершие части растений и т.д. превращая все это в минеральные вещества, которые в свою очередь усваивает флора.
Растения в свою очередь, кроме того что нуждается в углекислом газе в дневной фазе фотосинтеза, нуждаются и в кислороде - в ночное время, пусть даже и в значительно меньшем количестве чем рыбы.
На свету в клетках растений образуются сахара для их же питания и роста, и насыщают воду кислородом, который необходим живым организмам.
Кое-что из аквариума следует периодически, своевременно удалять - эту заботу мы берем на себя.
В правильно сбаллансированом аквариуме , достаточно лишь периодически подменить часть воды.
Остановимся подробнее на самых полезных , но менее всего понятных нам сапрофитах - микроорганизмах превращающих продукты жизнедеятельности организмов в питательные вещества для растений, таким образом поддерживая экологическое равновесие в акариуме и являются очень важной составляющей экосистемы.
Многие начинающие недооценивают вклад невидимых помошников.
Вместо того что бы постараться сбаллансировать все компоненты миниатюрного искуственного природного комплекса, они с первых дней пытаются навести в аквариуме никому не нужную идеальную чистоту, - льют в аквариум дезинфицирующие вещества, в место частичной подмены полностью выливают воду из него воду,промывают и даже кипятят грунт, отключат на ночь фильтр что бы не шумел и прочее.
Однако результат получают обратный желаемому: вода все равно мутнеет, растения погибают, а рыбы болеют. И все потому , что своими неумелыми и необдуманными действиями они уничтожают своих неоцинимых невидимых помошников - полезные микроорганизмы - грибы, инфузории и бактерии, питающиеся мертвым органическим веществом.
Они не претендуют на поедание живых клеток, поскольку этим занимаются действительно вредные микроорганизмы, вызывающие болезни.
Полезные микроорганизмы попадают в домашний водоем из атмосферы которая нас окружает, с растениями на листьях и корнях которых присутствует какое -то количество полезных микробов.
Оказавшись в подходящих условиях, полезные микроорганизмы начинают размножаться, пока их количество не достигнет определенного уровня, четко согласованного с числом рыб и растений в замкнутом пространстве аквариума. Поэтому неудивительно что больше всего их будет там где больше всего скапливается "грязь" - в грунте среди писчинок и в фильтрах.
Обычно, в только что правильно оборудованном аквариуме идеально чистой вода бывает только первый день-два, затем становится несколько сизой.
Полезных бактерий в это время явно не хватает, однако они способны быстро размножаться и уже максимум через неделю вода вновь становится кристально чистой.
С этого момента устанавливается определенный балланс и можно высаживать растения и добавлять по немногу рыб, - по немногу для того, что бы между микроорганизмами и количеством появляющихся в результате кормления рыб органических остатков которыми питаются бактерии успевал устанавливаться балланс. Мы можем способствовать процессу установления экологического равновесия: самый простой способ, применяемый аквариумистами уже не одно десятилетие - это добавить в новый аквариум небольшого количиства воды из уже устоявшегося и благополучного аквариума, врезультате чего ускоряется процесс заселения грунта и фильтра полезными микроорганизмами.
В наши дни без каких либо сложностей можно приобрести специальные препараты разных производителей - биостартеры, содержащие "рассаду" полезных микробов для вновь оборудуемых аквариумов, например: JBL Denitrol , TetraAqua Bactozym, Dennerle FB1. SubstrateStart, AQUAYER Биостартер и др.
Азотный цикл
Азот входящий в состав белков,конечно же , играет огромную роль в круговороте веществ любой экологической системы и аквариум как мы понимает тоже не исключение, это особенно важно поскольку не все соединения азота полезны для живых организмов.
Белки - органические вещества,являющиеся основой всего живого, содержат не мало азотных соединений.
Мы знаем что отмершие части растений, несъденый корм , экскременты рыб и пр. разлагаются сапрофитами, и азот из белков переходит в состав мене сложных химических соединений, приимущественно в аммоний (NH4), в малых концетрациях не приносящий вреда рыбам и растениям.
Сдержащие азот аммоний и нитрат являются важными питательными веществами для водных растений, которые они извлекают из воды.
Под воздействием бактерий он превращается в нитриты (NO2), которые снова таки под воздействием бактерий преобразуются в нитраты (NO3).
Бактерии (Bacterium coli, Bacterium proteus,Bacterium subtilis), которые обеспечивают превращения азота в нитраты и называются нитрифицирующими бактериями.
Таким образом происходит круговорот азота.
Несмотря на то, что в благополучном аквариуме азотный цикл осуществляется полностью, соотношения соединений при этом совершенно не такие как в большинстве природных водоемов.
Так как в аквариуме больше тех кто потребляет и меньше тех кто производит, при этом полезных бактерий в аквариуме значительно меньше чем в природе.
Из-за не правильного соотношения производителей и потребителей в воде в избытке могут накапливаться соеденения азота что приводит к вспышкам водорослей, угнетает рыбу и малька, замедляется фотосинтез у растений даже если освещение достаточно яркое.
В связи с этим старая вода в аквариуме не мене опасна, чем слишком свежая и поэтому для того что бы создать успешный и красивый аквариум , аквариумист обязательно должен соблюдать правила ухода за аквариумом с учетом индивидуальных особенностей конкретного домашнего водоема.
Для контроля концетраций азотных веществ в современной аквариумистике при необходимости применяются специальные тесты на нитрат, нитрит, аммиак/аммоний, фосфат разнообразных производителей. Как правило, в зависимости от типа аквариума допускаются следующие концетрации соединений азота в аквариуме:
1. NO3/нитрат - нормальная концетрация 0-25 мг/л, превышение 25-100 мг/л - у нежных рыб возможны отравления, свыше 100 неизбежны отравления и даже летальный исход.
2. NO2/нитрит - нормальная концетрация 0 мг/л , превышение (0.2-5) возможны отравления, свыше 5 неизбежны отравления и даже летальный исход.
3. NH4/аммоний - нормальная концетрация 0 мг/л, превышение (0.02-0.05) возможны отравления, свыше 0.05 неизбежны отравления и даже летальный исход . Это при плавном повышении. При резком скачке (например при неправильной пересадке рыбы или массированной подмене на чистую воду) последствия могут наступить и при меньших значениях!
4. РО4/фосфат - нормальная концетрация 0 - 2.0мг/л. Более высокие концетрации не столько опасны для рыб, сколько являются причиной появления водорослей. Материал взят из :
"Аквариум" Шереметьев И.И. 2002
"Современное аквариумное оборудование" В.Д. Полонский. 2006
"Настольная книга аквариумистов" Кочетов А. 1997
"Подготовка воды и изменение гидрохимических показателей" Хомченко И. 1991
"Вода как среда обитания и практика аквариумной гидрохимии" Махлин М.Д. 1988
"Содержание рыб в замкнутых системах" Спотт С. 1983
Основные параметры воды в аквариуме - какие они должны быть?
Фото аквариумов и аквариумных рыб
P.S. Вот вообщем и все, что я хотел рассказать новичкам, прежде чем они возьмутся за создание аквариума.
Сарперцев прошу тапками не кидать, несуществует ни одной книги в которой можно было бы быть согласным с каждым словом. .
Для тех, кто думает что так просто сесть и тупо переписать, скажу одно: попробуйте !
Возможно у вас получится лучше. :uch_tiv:
-
- Похожие темы
-
- Живая коретра, ответов 5, последний от
-
- Живая дафния, ответов 13, последний от
-
- Креветка вишня живая, но без задней части тела, ответов 3, последний от
-
- Вода, ответов 8, последний от
-
- Белая вода, ответов 13, последний от